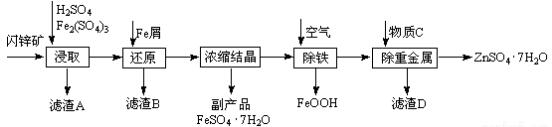
题目内容
9.已知合成尿素的总反应为:2NH3(g)+C O2(g)→C O(NH2)2(s)+H2O(l)+Q,它可以分两步进行:(1)2NH3(g)+C O2(g)→NH2COONH4(s)+Q1
(2)NH2COONH4(s)→C O(NH2)2(s)+H2O(l)-Q2
下列正确表达合成尿素过程中能量变化的是( )
| A. | 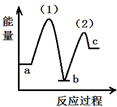 | B. | 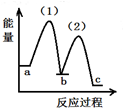 | C. | 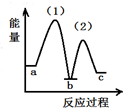 | D. | 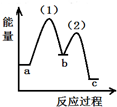 |
分析 根据反应物和生成物的能量高低与反应吸放热之间的关系来判断.当反应物的能量高于生成物的能量时,反应是放热反应,当反应物的能量低于生成物的能量时,反应是吸热反应,依据反应(1):2NH3(g)+CO2(g)?NH2COONH4(s)+Q1△H1<0,反应(2):NH2COONH4(s)?CO(NH2)2(I)+H2O(l)-Q2 △H2>0,可以知道2NH3(g)和CO2(g)的能量和高于NH2COONH4(s)的能量,NH2COONH4(s)的能量低于CO(NH2)2(I)+H2O(I)的能量.
解答 解:当反应物的能量高于生成物的能量时,反应是放热反应,当反应物的能量低于生成物的能量时,反应是吸热反应,
依据反应(1):2NH3(g)+CO2(g)?NH2COONH4(s)+Q1△H1<0
反应(2):NH2COONH4(s)?CO(NH2)2(I)+H2O(l)-Q2△H2>0,可以知道2NH3(g)和CO2(g)的能量和高于NH2COONH4(s)的能量,NH2COONH4(s)的能量低于CO(NH2)2(I)+H2O(I)的能量;
A、NH2COONH4(s)的能量高于2NH3(g)和CO2(g)的能量不符合(1)(2)能量变化,故A错误;
B、NH2COONH4(s)的能量高于CO(NH2)2(I)+H2O(I)的能量;不符合反应(2)能量变化,故B错误;
C、图象可以知道2NH3(g)和CO2(g)的能量和高于NH2COONH4(s)的能量,NH2COONH4(s)的能量低于CO(NH2)2(I)+H2O(I)的能量;符合反应(1)(2)能量变化,故C正确;
D、2NH3(g)和CO2(g)的能量和低于NH2COONH4(s)的能量,不符合反应(1)能量变化,故D错误;
故选C.
点评 本题考查了反应能量变化的分析判断,图象分析方法,物质的能量和反应吸热放热是解题关键,题目难度中等.

| A. | O2和O3的混合物共16g,其中所含氧原子数为NA | |
| B. | 1.0L 0.1mol/L的AlCl3溶液中含有的铝离子数为0.1NA | |
| C. | 28g乙烯中所含有共用电子对数目为4NA | |
| D. | 1mol金属钠完全转化为Na2O2所转移的电子数目为2NA |

| A. | 原子半径:A<B<C<D | |
| B. | E、F和H三种元素相应的最高价氧化物对应水化物之间两两会发生反应 | |
| C. | 气态氢化物稳定性:D>I>G>H | |
| D. | E和C元素形成的化合物中只存在离子键 |
| A. | 天然油脂--混合物 | B. | 氯气--非电解质 | ||
| C. | 二氧化氮--酸酐 | D. | 二氯甲烷--非极性分子 |
| 钠 | Na2CO3 | 金刚石 | 石墨 | |
| 熔点(℃) | 97.8 | 851 | 3550 | 3850 |
| 沸点(℃) | 882.9 | 1850(分解产生CO2) | ---- | 4250 |
完成下列填空:
(1)若反应在常压、890℃下进行,写出该反应的平衡常数表达式$\frac{1}{{c}^{4}(Na)×{c}^{3}(C{O}_{2})}$.
(2)请写出一条既能提高反应速率又能提高转化率的方法:增大压强
(3)890℃,下列关于该反应的说法正确的是b(选填序号).
a.容器内气体的平均式量不再变化,则反应一定达到平衡
b.容器内固体质量不再变化,则反应一定达到平衡
c.反应起始至平衡,气体的密度不断增大
d.反应起始至平衡,容器内的压强不断增大
(4)890℃,若该反应在10L密闭容器、常压下进行,反应4h,固体质量增加56克,则二氧化碳的反应速率为0.35mol/(L•h)
(5)若温度由890℃升高到1860℃,则容器内气体的平均相对分子质量将增大(选填“增大”“减小”“不变”),
(6)若反应后要得到纯净的金刚石,请写出必要的实验操作步骤.冷却后,将反应后容器中的固体取出,加水溶解、过滤、洗涤固体并烘干,可得纯净的金刚石
(7)在此反应中,同时还会有石墨生成,已知:C(s,石墨)?C(s,金刚石)-1.9KJ,若升高温度,生成的碳单质中,金刚石的含量将增大(选填“增大”“减小”“不变”).等物质的量的石墨和金刚石中,化学键的数目较多的是金刚石.
| A. | 标准状况下,11.2 L SO3中含有0.5NA个SO3分子 | |
| B. | 48g O3气体含有3NA个氧原子 | |
| C. | 在1L0.5mol•L-lFeCl3溶液中含有0.5NA个Fe3+ | |
| D. | 1.5 mol NO2与足量水反应,转移的电子数为1.5NA |
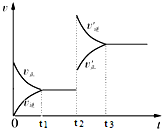 向一体积不变的密闭容器中充入H2和I2,发生反应H2(g)+I2(g)?2HI(g)△H<0,当达到平衡后,t2时刻改变反应的某一条件(混合气体总物质的量不变),速率变化如图所示,则下列说法正确的是( )
向一体积不变的密闭容器中充入H2和I2,发生反应H2(g)+I2(g)?2HI(g)△H<0,当达到平衡后,t2时刻改变反应的某一条件(混合气体总物质的量不变),速率变化如图所示,则下列说法正确的是( )| A. | 重新达到平衡后,平衡常数K增大 | B. | t2时刻改变的条件可以是升高温度 | ||
| C. | I2(g)转化率增大,HI平衡浓度增大 | D. | t2时刻改变是可以增大压强 |