题目内容
8.短周期元素X、Y、Z、W、R的化合价与原子序数的关系如图所示.下列说法正确的是( )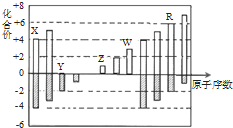
| A. | 原子半径:Z>Y>X | |
| B. | Z和Y形成的化合物是离子化合物 | |
| C. | 气态氢化物的稳定性:Y<R | |
| D. | 常温下单质W能溶于R的最高价氧化物对应水化物的浓溶液 |
分析 由表中化合价可知,Y的化合价为-2价,没有正化合价,故Y为O元素,X的化合价为+4、-4价,处于ⅣA族,原子序数比O元素小,故X为C元素,Z的化合价为+1价,处于ⅠA族,原子序数大于O元素,故Z为Na元素,W为+3价,为Al元素,R的化合价为+6、-2价,故R为S元素.
解答 解:由表中化合价可知,Y的化合价为-2价,没有正化合价,故Y为O元素,X的化合价为+4、-4价,处于ⅣA族,原子序数比O元素小,故X为C元素,Z的化合价为+1价,处于ⅠA族,原子序数大于O元素,故Z为Na元素,W为+3价,为Al元素,R的化合价为+6、-2价,故R为S元素,
A.同周期随原子序数增大原子半径减小,同主族自上而下原子半径增大,故原子半径Na>C>O,即Z>X>Y,故A错误;
B.Z和Y形成的化合物是氧化钠、过氧化钠,属于离子化合物,故B正确;
C.非金属性O>S,即Y>R,非金属性越强氢化物越稳定,故气态氢化物的稳定性:Y>R,故C错误;
D.Al在浓硫酸中发生钝化现象,不能溶解,故D错误;
故选B.
点评 本题考查结构性质与位置关系等,难度不大,注意根据化合价结合原子序数推断元素,熟练掌握元素周期律.

练习册系列答案
相关题目
18.化学与生活、生产密切相关,下列说法不正确的是( )
| A. | 食盐可做调味剂、防腐剂 | |
| B. | 硅酸钠可做木材防火剂的原料 | |
| C. | 二氧化硫在葡萄酒中起漂白作用 | |
| D. | 还原铁粉可用于食品包装袋内的脱氧剂 |
3.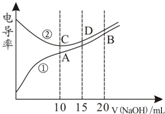 电解质溶液的电导率越大,导电能力越强.用0.100mol•L-1的NaOH溶液滴定10.00mL浓度均为0.100mol•L-1的盐酸和CH3COOH溶液.利用传感器测得滴定过程中溶液的电导率如图所示.下列说法正确的是( )
电解质溶液的电导率越大,导电能力越强.用0.100mol•L-1的NaOH溶液滴定10.00mL浓度均为0.100mol•L-1的盐酸和CH3COOH溶液.利用传感器测得滴定过程中溶液的电导率如图所示.下列说法正确的是( )
 电解质溶液的电导率越大,导电能力越强.用0.100mol•L-1的NaOH溶液滴定10.00mL浓度均为0.100mol•L-1的盐酸和CH3COOH溶液.利用传感器测得滴定过程中溶液的电导率如图所示.下列说法正确的是( )
电解质溶液的电导率越大,导电能力越强.用0.100mol•L-1的NaOH溶液滴定10.00mL浓度均为0.100mol•L-1的盐酸和CH3COOH溶液.利用传感器测得滴定过程中溶液的电导率如图所示.下列说法正确的是( )| A. | 曲线①代表滴定HCl溶液的曲线 | |
| B. | A点溶液中:c(CH3COO-)+c(OH-)-c(H+)=0.1 mol•L-1 | |
| C. | 在相同温度下,A、B、C三点溶液中水的电离程度:C<B<A | |
| D. | D点溶液中:2c(Na+)=3c(Cl-) |
13.下列说法正确的是( )
| A. | Fe在少量Cl2中燃烧生成FeCl2 | |
| B. | 蛋白质的盐析和变性均是化学变化 | |
| C. | 化学反应的焓变与反应物和生成物的状态无关 | |
| D. | 按a、b两种途径由铜制备相同量的硝酸铜,途径a、b消耗的铜一样多 途径a:Cu$→_{△}^{O_{2}}$CuO$\stackrel{稀硝酸}{→}$Cu(NO3)2;途径b:Cu$\stackrel{稀硝酸}{→}$Cu(NO3)2 |
20. 硼化钒(VB2)-空气电池是目前储电能力最高的电池,电池示意图如图,该电池工作时反应为:4VB2+11O2→4B2O3+2V2O5.下列说法正确的是( )
硼化钒(VB2)-空气电池是目前储电能力最高的电池,电池示意图如图,该电池工作时反应为:4VB2+11O2→4B2O3+2V2O5.下列说法正确的是( )
 硼化钒(VB2)-空气电池是目前储电能力最高的电池,电池示意图如图,该电池工作时反应为:4VB2+11O2→4B2O3+2V2O5.下列说法正确的是( )
硼化钒(VB2)-空气电池是目前储电能力最高的电池,电池示意图如图,该电池工作时反应为:4VB2+11O2→4B2O3+2V2O5.下列说法正确的是( )| A. | 电极a为电池负极,发生还原反应 | |
| B. | 每消耗1mol VB2转移6mol电子 | |
| C. | 电池工作时,OH-向电极a移动 | |
| D. | VB2极发生的电极反应为:2VB2+22OH--22e-→V2O5+2B2O3+11H2O |
17.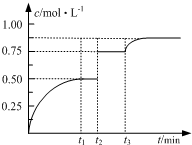 一定温度下,将1molA和1molB气体充入2L恒容密闭容器,发生反应A(g)+B(g)?2C(g)+D(s),t1时达到平衡.在t2、t3时刻分别改变反应的一个条件,测得容器中气体C的浓度随时间变化如图所示.下列说法正确的是( )
一定温度下,将1molA和1molB气体充入2L恒容密闭容器,发生反应A(g)+B(g)?2C(g)+D(s),t1时达到平衡.在t2、t3时刻分别改变反应的一个条件,测得容器中气体C的浓度随时间变化如图所示.下列说法正确的是( )
 一定温度下,将1molA和1molB气体充入2L恒容密闭容器,发生反应A(g)+B(g)?2C(g)+D(s),t1时达到平衡.在t2、t3时刻分别改变反应的一个条件,测得容器中气体C的浓度随时间变化如图所示.下列说法正确的是( )
一定温度下,将1molA和1molB气体充入2L恒容密闭容器,发生反应A(g)+B(g)?2C(g)+D(s),t1时达到平衡.在t2、t3时刻分别改变反应的一个条件,测得容器中气体C的浓度随时间变化如图所示.下列说法正确的是( )| A. | 若t1=2min,则υ(A)=0.50mol•(L•min)-1 | |
| B. | 若t3时刻升高了温度,则该反应的△H<0 | |
| C. | 若t1时刻后向体系中再充入A、B、C各1mol,则υ(正)>υ(逆) | |
| D. | 保持温度不变,起始时向该容器中充入1molA和1molB,加入2molD,则达平衡时A的转化率小于50% |
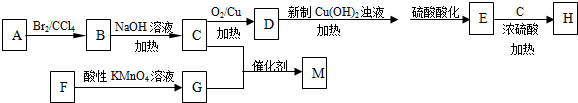
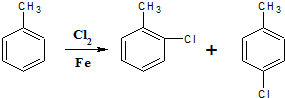 ;
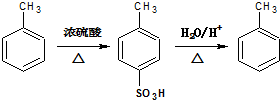
;
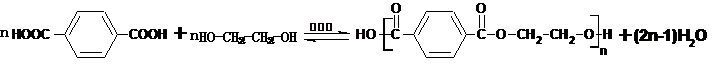
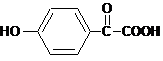 .
.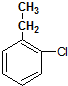 .
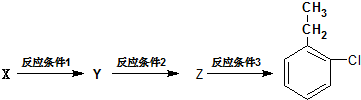
.
 .
.