题目内容
17.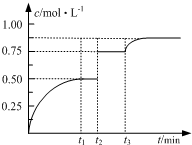 一定温度下,将1molA和1molB气体充入2L恒容密闭容器,发生反应A(g)+B(g)?2C(g)+D(s),t1时达到平衡.在t2、t3时刻分别改变反应的一个条件,测得容器中气体C的浓度随时间变化如图所示.下列说法正确的是( )
一定温度下,将1molA和1molB气体充入2L恒容密闭容器,发生反应A(g)+B(g)?2C(g)+D(s),t1时达到平衡.在t2、t3时刻分别改变反应的一个条件,测得容器中气体C的浓度随时间变化如图所示.下列说法正确的是( )| A. | 若t1=2min,则υ(A)=0.50mol•(L•min)-1 | |
| B. | 若t3时刻升高了温度,则该反应的△H<0 | |
| C. | 若t1时刻后向体系中再充入A、B、C各1mol,则υ(正)>υ(逆) | |
| D. | 保持温度不变,起始时向该容器中充入1molA和1molB,加入2molD,则达平衡时A的转化率小于50% |
分析 A.算出A的浓度变化量,再根据v=$\frac{△c}{△t}$计算;
B.图象说明t3时刻C的浓度增大,平衡正向移动,结合温度对平衡的影响进行分析;
C.用Qc与平衡常数K比较后判断;
D.加入固体D,平衡不移动.
解答 解:A.若t1=2min,C的浓度为0.5mol/L,则A消耗了0.25mol/L,υ(A)═$\frac{△c}{△t}$=$\frac{0.25mol/L}{2min}$=0.125mol/(L•min),故A错误;
B.图象说明t3时刻C的浓度增大,平衡正向移动,若t3时刻升温,平衡会向吸热方向移动,即正方向为吸热反应,△H>0,故B错误;
C.t1时刻达平衡,此时A、B、C的浓度分别是0.25mol/L、0.25mol/L、0.5mol/L,K=$\frac{0.{5}^{2}}{0.25×0.25}$=4,t1时刻后向体系中再充入A、B、C各1mol,些时A、B、C的浓度分别是(0.25+0.5)mol/L、(0.25+0.5)mol/L、(0.5+0.5)mol/L,Qc=$\frac{{1}^{2}}{0.75×0.75}$=1.8<K,则平衡正向移动,正反应占优势,则υ(正)>υ(逆),故C正确;
D.加入固体D,平衡不移动,达平衡时A的转化率不变,故D错误;
故选:C.
点评 本题考查化学平衡图象、化学反应速率的计算、外界条件对化学平衡的影响,利用浓度熵与平衡常数的关系来判断平衡移动的方向,难度中等.

练习册系列答案
相关题目
7.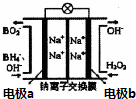 以NaBH4和H2O2为燃料的燃料电池可用于通信卫星.其负极材料采用Pt/C,正极材料采用MnO2,电池的工作原理如图所示.下列说法错误的是( )
以NaBH4和H2O2为燃料的燃料电池可用于通信卫星.其负极材料采用Pt/C,正极材料采用MnO2,电池的工作原理如图所示.下列说法错误的是( )
 以NaBH4和H2O2为燃料的燃料电池可用于通信卫星.其负极材料采用Pt/C,正极材料采用MnO2,电池的工作原理如图所示.下列说法错误的是( )
以NaBH4和H2O2为燃料的燃料电池可用于通信卫星.其负极材料采用Pt/C,正极材料采用MnO2,电池的工作原理如图所示.下列说法错误的是( )| A. | 电池放电时,Na+从a极区移向b极区 | |
| B. | 电极b采用MnO2,该极附近溶液的pH保持不变 | |
| C. | 该电池的负极反应为:BH4-+8OH--8e-=BO2-+6H2O | |
| D. | 电池放电时,电子从a极经导线流向b极 |
8.短周期元素X、Y、Z、W、R的化合价与原子序数的关系如图所示.下列说法正确的是( )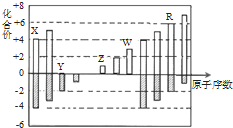

| A. | 原子半径:Z>Y>X | |
| B. | Z和Y形成的化合物是离子化合物 | |
| C. | 气态氢化物的稳定性:Y<R | |
| D. | 常温下单质W能溶于R的最高价氧化物对应水化物的浓溶液 |
5.下列关于化学用语的表示正确的是( )
| A. | 质子数为8、中子数为10的氧原子:${\;}_{8}^{10}$O | |
| B. | 氯离子的结构示意图: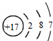 | |
| C. | 对苯二甲酸的结构简式: | |
| D. | NaHCO3在水溶液中的电离方程式:NaHCO3=Na++HCO3- |
12.下列指定反应的离子方程式正确的是( )
| A. | NO2溶于水:3NO2+H2O=2H++2NO3-+NO↑ | |
| B. | 用氨水吸收足量的SO2气体:2OH-+SO2=SO32-+H2O | |
| C. | 溴乙烷与氢氧化钠水溶液共热:C2H5Br+OH-$→_{△}^{H_{2}O}$ CH2=CH2↑+Br-+H2O | |
| D. | 用酸性K2Cr2O7溶液检验酒精:3CH3CH2OH+2Cr2O72-+2H2O=4Cr(OH)3↓+3CH3COO-+OH- |
2.25℃时,下列各组离子在指定溶液中一定能大量共存的是( )
| A. | pH=2的溶液中:K+、Mg2+、I-、S2- | |
| B. | Br-不能大量存在的溶液中:Fe2+、Ca2+、Cl-、NO3- | |
| C. | c(H+)=10-12mol•L-1的溶液中:Na+、Ba2+、NO3-、Cl- | |
| D. | 0.1 mol•L-1FeCl3溶液中:Mg2+、NH4+、SCN-、SO42- |
9.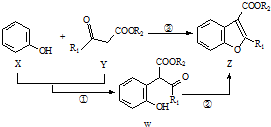 如图表示在催化剂作用下将X和Y合成具有生物活性的物质Z,W是中间产物(R1、R2均为烃基).则下列有关叙述错误的是( )
如图表示在催化剂作用下将X和Y合成具有生物活性的物质Z,W是中间产物(R1、R2均为烃基).则下列有关叙述错误的是( )
 如图表示在催化剂作用下将X和Y合成具有生物活性的物质Z,W是中间产物(R1、R2均为烃基).则下列有关叙述错误的是( )
如图表示在催化剂作用下将X和Y合成具有生物活性的物质Z,W是中间产物(R1、R2均为烃基).则下列有关叙述错误的是( )| A. | 反应①属于加成反应 | |
| B. | W能发生加成、水解、氧化反应 | |
| C. | X在一定条件下可发生缩聚反应 | |
| D. | 一定条件下Z与足量H2反应后所得产物中至少含有4个手性碳原子 |
3.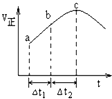 向某恒容密闭容器中通入N2和H2,在500℃时,使反应:N2(g)+3H2(g)?2NH3(g)△H<0达到平衡,正反应速率随时间变化的示意图如图所示.由图可得出的正确结论是( )
向某恒容密闭容器中通入N2和H2,在500℃时,使反应:N2(g)+3H2(g)?2NH3(g)△H<0达到平衡,正反应速率随时间变化的示意图如图所示.由图可得出的正确结论是( )
 向某恒容密闭容器中通入N2和H2,在500℃时,使反应:N2(g)+3H2(g)?2NH3(g)△H<0达到平衡,正反应速率随时间变化的示意图如图所示.由图可得出的正确结论是( )
向某恒容密闭容器中通入N2和H2,在500℃时,使反应:N2(g)+3H2(g)?2NH3(g)△H<0达到平衡,正反应速率随时间变化的示意图如图所示.由图可得出的正确结论是( )| A. | 反应在c点达到平衡状态 | |
| B. | △t1=△t2时,N2的转化量:a~b段小于b~c段 | |
| C. | C点反应放出的热量达到最大 | |
| D. | 反应物浓度:a点小于b点 |
4.短周期主族元素X、Y、Z、W的原子序数均为偶数且依次增大,元素X原子的最外层电子数是其内层电子总数的3倍,下列说法错误的是( )
| A. | 元素X的简单气态氢化物的热稳定性比W的强 | |
| B. | 元素W的最高价氧化物对应水化物的酸性比Z的强 | |
| C. | 元素Y、Z的单质都有金属光泽 | |
| D. | X分别与Y、Z、W形成的化合物所含化学键类型相同 |