题目内容
20.下列画有横线的反应物在反应中不能完全消耗的是( )| A. | 将含有少量CO2的CO通入足量Na2O2的试管中并不断用电火花引燃 | |
| B. | 向等物质的量的干冰和CaO的混合物中加几滴水 | |
| C. | 在强光持续照射下,向过量的Ca(ClO)2浊液中通入少量的CO2 | |
| D. | 将1molCu置于含2molH2SO4的浓溶液中加热 |
分析 A.二氧化碳能够与过氧化钠反应生成氧气,氧气能够于一氧化碳反应;
B.二氧化碳与水反应生成碳酸,与等物质的量的CaO恰好完全反应;
C.反应生成碳酸钙和HClO,光照下HClO分解,最终二氧化碳完全反应;
D.铜只能与浓硫酸反应,与稀硫酸不反应.
解答 解:A.电火花不断引燃,CO燃烧生成二氧化碳,二氧化碳能与足量Na2O2反应,最终气体完全反应,相当于CO与Na2O2反应生成碳酸难,CO完全消耗,故A不选;
B.二氧化碳与水反应生成碳酸,与等物质的量的CaO恰好完全反应,干冰完全消耗,故B不选;
C.反应生成碳酸钙和HClO,光照下HClO分解,最终二氧化碳完全反应,而次氯酸钙过量,不能完全消耗,故C选;
D.随反应的进行,浓硫酸不断消耗,浓度减小变为稀硫酸,稀硫酸不与Cu反应,则Cu、硫酸均不能完全消耗,故D选;
故选:CD.
点评 本题考查了元素化合物的性质,明确相关物质的性质及发生的反应是解题关键,注意铜与浓硫酸反应条件,题目难度中等.

练习册系列答案
相关题目
8.下列离子方程式书写正确的是( )
| A. | 在强碱溶液中NaClO与Fe(OH)3反应生成Na2FeO4:3ClO-+2Fe(OH)3+4OH-═2FeO42-+3Cl-+5H2O | |
| B. | Fe(OH)3溶于氢碘酸:Fe(OH)3+3H+═Fe3++3H2O | |
| C. | 铜溶于浓硝酸:3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O | |
| D. | 钠与水反应:Na+2H2O═Na++2OH-+H2↑ |
15.用NA表示阿伏加德罗常数,下列说法错误的是( )
| A. | 25℃时1mL水中含10-10 NA个OH-离子 | |
| B. | 1molCl2通入足量的NaOH溶液中充分反应转移的电子数为2NA | |
| C. | a g某气体含分子数为b,c g该气体在标况下的体积约为22.4bc/(aNA)L | |
| D. | 0.1mol钠和O2在一定条件下反应生成Na2O和Na2O2混合物时,失去电子数为0.1NA |
5.下列说法正确的是( )
| A. | 某物质的溶液中由水电离出的c(H+)=1×10-amol/L,若a>7时,则该溶液的pH一定为14-a | |
| B. | 相同物质的量浓度的下列溶液中,①NH4Al(SO4)2、②(NH4)2SO4、③CH3COONH4、④NH3•H2O;c(NH4+)由大到小的顺序是:②>①>③>④ | |
| C. | 物质的量浓度相等的 H2S 和 NaHS 混合溶液中:c(Na+)+c(H+)=c(S2-)+c (HS-)+c(OH-) | |
| D. | AgCl悬浊液中存在平衡:AgCl(s)?Ag+(aq)+Cl-(aq),往其中加入少量 NaCl粉末,平衡会向左移动,Ksp减少 |
12.下列离子方程式不正确的是( )
| A. | NaHCO3与NaOH溶液反应:HCO3-+OH-═CO32-+H2O | |
| B. | 氯气和水反应:Cl2+H2O?2H++Clˉ+ClOˉ | |
| C. | 氯化铁溶液中加入足量的氨水:Fe3++3NH3•H2O=Fe(OH)3↓+3NH4+ | |
| D. | 盛放碱性试剂的溶液不能用玻璃塞的原因:SiO2+2OH-═SiO32-+H2O |
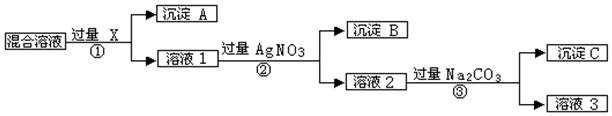
9.某同学查阅教材上的溶解性表时发现,CuCO3对应的为“-”,表示不存在或遇水就分解.已知铜离子的常见沉淀为Cu(OH)2(蓝色)、Cu2(OH)2SO4(蓝色)、Cu2(OH)2CO3(绿色)等,它们均不含结晶水.为了探究CuSO4和Na2CO3反应产物的成份,该同学按以下实验方法制备了两种沉淀,并设计了探究沉淀成份的实验.
取2个小烧杯和2个锥形瓶,在每个烧杯里加入50mL0.5mol/L的CuSO4溶液,在锥形瓶里分别加入40mL 和50mL0.5mol/LNa2CO3溶液,置于70℃水中水浴加热,然后将CuSO4溶液加入到Na2CO3溶液中,继续水浴,均有气泡产生,几分钟后分别得到蓝绿色和绿色沉淀.过滤、洗涤、干燥,得到两份固体.
I.对蓝绿色沉淀成份的探究.
通过右边实验证实,沉淀中含有Cu2(OH)2CO3和Cu2(OH)2SO4

(1)证明有Cu2(OH)2CO3存在的现象为试管2有气泡产生;
(2)试剂①为BaCl2或Ba(NO3)2溶液,证明有Cu2(OH)2SO4存在的现象为试管3有白色沉淀产生.
II.对绿色沉淀成份的探究
重复I实验,发现没有SO42-存在,有Cu2(OH)2CO3存在;
通过下列实验证实,沉淀中只有Cu2(OH)2CO3
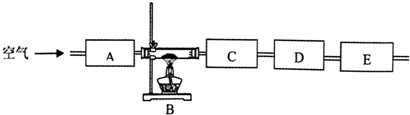
(3)该同学想通过测量固体分解所得气体的质量来确定沉淀的成份,按上述思路组装好装置,加入相应的药品,并指出所加药品的目的.
(4)按照该同学的设计思路,只需测定某两个装置的质量变化,即△m (C):△m(D)=9:22时(括号中填写装置的序号)就可确定固体是Cu2(OH)2CO3.
(5)结论:n(Cu2+):n(CO32-)>1时,所得固体产物有Cu2(OH)2CO3和Cu2(OH)2SO4;n(Cu2+):n(CO32-)≤1时,所得固体产物全部是Cu2(OH)2CO3,生成该沉淀发生反应的离子方程式为:2Cu2++2CO32-+H2O=Cu2(OH)2CO3↓+CO2↑.
取2个小烧杯和2个锥形瓶,在每个烧杯里加入50mL0.5mol/L的CuSO4溶液,在锥形瓶里分别加入40mL 和50mL0.5mol/LNa2CO3溶液,置于70℃水中水浴加热,然后将CuSO4溶液加入到Na2CO3溶液中,继续水浴,均有气泡产生,几分钟后分别得到蓝绿色和绿色沉淀.过滤、洗涤、干燥,得到两份固体.
I.对蓝绿色沉淀成份的探究.
通过右边实验证实,沉淀中含有Cu2(OH)2CO3和Cu2(OH)2SO4

(1)证明有Cu2(OH)2CO3存在的现象为试管2有气泡产生;
(2)试剂①为BaCl2或Ba(NO3)2溶液,证明有Cu2(OH)2SO4存在的现象为试管3有白色沉淀产生.
II.对绿色沉淀成份的探究
重复I实验,发现没有SO42-存在,有Cu2(OH)2CO3存在;
通过下列实验证实,沉淀中只有Cu2(OH)2CO3

(3)该同学想通过测量固体分解所得气体的质量来确定沉淀的成份,按上述思路组装好装置,加入相应的药品,并指出所加药品的目的.
| 仪器 编号 | 药品 | 目的 |
| A | 碱石灰 | |
| B | 绿色固体 | |
| C | ||
| D | ||
| E | 碱石灰 |
(5)结论:n(Cu2+):n(CO32-)>1时,所得固体产物有Cu2(OH)2CO3和Cu2(OH)2SO4;n(Cu2+):n(CO32-)≤1时,所得固体产物全部是Cu2(OH)2CO3,生成该沉淀发生反应的离子方程式为:2Cu2++2CO32-+H2O=Cu2(OH)2CO3↓+CO2↑.
10.下列属于氧化还原反应的是( )
| A. | 2KI+Br2═2KBr+I2 | B. | CaCO3$\frac{\underline{\;\;△\;\;}}{\;}$CaO+CO2↑ | ||
| C. | SO3+H2O $\frac{\underline{\;\;△\;\;}}{\;}$H2SO4 | D. | MgCl2+2NaOH $\frac{\underline{\;\;△\;\;}}{\;}$Mg(OH)2↓+NaCl |
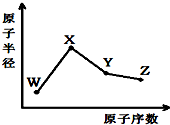 W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如图.已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的非金属性在同周期元素中最强.回答下列问题:
W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如图.已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的非金属性在同周期元素中最强.回答下列问题: .
.