题目内容
19.下列物质的水溶液能导电,但属于非电解质的是( )| A. | C12H22O11 | B. | SO3 | C. | NaHCO3 | D. | Br2 |
分析 电解质是指在水溶液或熔化状态下能导电的化合物,而非电解质是指在水溶液和熔化状态下都不能导电的化合物.
解答 解:A、C12H22O11其水溶液不导电,是非电解质,故A错误;
B、SO3的水溶液能导电,是因SO3和水反应生成硫酸,硫酸电离生成离子而导电,即发生电离不是SO3本身,故SO3属于非电解质,故B正确;
C、NaHCO3的水溶液导电,属于电解质,故C错误;
D、Br2其水溶液导电,但不是物质本身导电,Br2的成分是单质,不是非电解质,故D错误.
故选B.
点评 本题考查电解质和非电解质,学生应明确电解质和非电解质都是化合物,并明确判断电解质时发生电离的为化合物本身来分析解答即可.

练习册系列答案
相关题目
9.某同学查阅教材上的溶解性表时发现,CuCO3对应的为“-”,表示不存在或遇水就分解.已知铜离子的常见沉淀为Cu(OH)2(蓝色)、Cu2(OH)2SO4(蓝色)、Cu2(OH)2CO3(绿色)等,它们均不含结晶水.为了探究CuSO4和Na2CO3反应产物的成份,该同学按以下实验方法制备了两种沉淀,并设计了探究沉淀成份的实验.
取2个小烧杯和2个锥形瓶,在每个烧杯里加入50mL0.5mol/L的CuSO4溶液,在锥形瓶里分别加入40mL 和50mL0.5mol/LNa2CO3溶液,置于70℃水中水浴加热,然后将CuSO4溶液加入到Na2CO3溶液中,继续水浴,均有气泡产生,几分钟后分别得到蓝绿色和绿色沉淀.过滤、洗涤、干燥,得到两份固体.
I.对蓝绿色沉淀成份的探究.
通过右边实验证实,沉淀中含有Cu2(OH)2CO3和Cu2(OH)2SO4

(1)证明有Cu2(OH)2CO3存在的现象为试管2有气泡产生;
(2)试剂①为BaCl2或Ba(NO3)2溶液,证明有Cu2(OH)2SO4存在的现象为试管3有白色沉淀产生.
II.对绿色沉淀成份的探究
重复I实验,发现没有SO42-存在,有Cu2(OH)2CO3存在;
通过下列实验证实,沉淀中只有Cu2(OH)2CO3
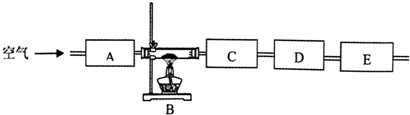
(3)该同学想通过测量固体分解所得气体的质量来确定沉淀的成份,按上述思路组装好装置,加入相应的药品,并指出所加药品的目的.
(4)按照该同学的设计思路,只需测定某两个装置的质量变化,即△m (C):△m(D)=9:22时(括号中填写装置的序号)就可确定固体是Cu2(OH)2CO3.
(5)结论:n(Cu2+):n(CO32-)>1时,所得固体产物有Cu2(OH)2CO3和Cu2(OH)2SO4;n(Cu2+):n(CO32-)≤1时,所得固体产物全部是Cu2(OH)2CO3,生成该沉淀发生反应的离子方程式为:2Cu2++2CO32-+H2O=Cu2(OH)2CO3↓+CO2↑.
取2个小烧杯和2个锥形瓶,在每个烧杯里加入50mL0.5mol/L的CuSO4溶液,在锥形瓶里分别加入40mL 和50mL0.5mol/LNa2CO3溶液,置于70℃水中水浴加热,然后将CuSO4溶液加入到Na2CO3溶液中,继续水浴,均有气泡产生,几分钟后分别得到蓝绿色和绿色沉淀.过滤、洗涤、干燥,得到两份固体.
I.对蓝绿色沉淀成份的探究.
通过右边实验证实,沉淀中含有Cu2(OH)2CO3和Cu2(OH)2SO4

(1)证明有Cu2(OH)2CO3存在的现象为试管2有气泡产生;
(2)试剂①为BaCl2或Ba(NO3)2溶液,证明有Cu2(OH)2SO4存在的现象为试管3有白色沉淀产生.
II.对绿色沉淀成份的探究
重复I实验,发现没有SO42-存在,有Cu2(OH)2CO3存在;
通过下列实验证实,沉淀中只有Cu2(OH)2CO3

(3)该同学想通过测量固体分解所得气体的质量来确定沉淀的成份,按上述思路组装好装置,加入相应的药品,并指出所加药品的目的.
| 仪器 编号 | 药品 | 目的 |
| A | 碱石灰 | |
| B | 绿色固体 | |
| C | ||
| D | ||
| E | 碱石灰 |
(5)结论:n(Cu2+):n(CO32-)>1时,所得固体产物有Cu2(OH)2CO3和Cu2(OH)2SO4;n(Cu2+):n(CO32-)≤1时,所得固体产物全部是Cu2(OH)2CO3,生成该沉淀发生反应的离子方程式为:2Cu2++2CO32-+H2O=Cu2(OH)2CO3↓+CO2↑.
10.下列属于氧化还原反应的是( )
| A. | 2KI+Br2═2KBr+I2 | B. | CaCO3$\frac{\underline{\;\;△\;\;}}{\;}$CaO+CO2↑ | ||
| C. | SO3+H2O $\frac{\underline{\;\;△\;\;}}{\;}$H2SO4 | D. | MgCl2+2NaOH $\frac{\underline{\;\;△\;\;}}{\;}$Mg(OH)2↓+NaCl |
14.海水中蕴藏着丰富的资源,在实验室中去少量海水,进行如下流程的实验:
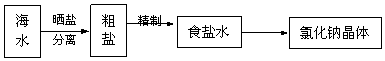
粗盐中含Ca2+、Mg2+、Fe3+、SO42-等杂质,提纯的步骤有:①加入过量的Na2CO3溶液; ②加入过量的BaCl2溶液; ③加入过量的NaOH溶液;④加入适量盐酸; ⑤溶解; ⑥过滤; ⑦蒸发.
其正确的操作顺序是( )(填写序号字母).

粗盐中含Ca2+、Mg2+、Fe3+、SO42-等杂质,提纯的步骤有:①加入过量的Na2CO3溶液; ②加入过量的BaCl2溶液; ③加入过量的NaOH溶液;④加入适量盐酸; ⑤溶解; ⑥过滤; ⑦蒸发.
其正确的操作顺序是( )(填写序号字母).
| A. | ⑤②③①⑥④⑦ | B. | ⑤①②③⑥④⑦ | C. | ⑤②①③④⑥⑦ | D. | ⑤③②①⑥④⑦ |
4.在5mL0.1mol•L-1KI溶液中滴加0.1mol•L-1FeCl3溶液1mL,充分振荡后,再进行下列实验,其中可证明该反应有一定限度的实验是( )
| A. | 再滴加AgNO3溶液,观察是否有AgI沉淀产生 | |
| B. | 加入CCl4振荡后,观察下层液体颜色 | |
| C. | 加入CCl4振荡后,取上层清液,滴加KSCN溶液,观察是否出现红色 | |
| D. | 加入CCl4振荡后,取上层清液,滴加入AgNO3溶液,观察是否有AgCl沉淀产生 |
11.用NA表示阿伏加德罗常效的数值,下列说法正确的是( )
| A. | 20gD2O中含有的中子数为10NA | |
| B. | 0.1molCl2与足量的NaOH溶液反应,转移的电子数为0.2NA | |
| C. | 常温下,pH=13 的NaOH溶液中含有的OH-数为0.1NA | |
| D. | 标准状况下,11.2LCCl4中含有C-Cl键的数目为2NA |
8.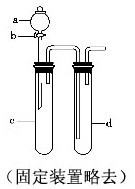 铜与稀硝酸反应产生NO,NO又被氧化成NO2,对实验观察无色NO有干扰,过多的NO、NO2又会污染环境,改进实验的涉及符合绿色化学的思想.有兴趣小组设计出如图所示装置来改进教材中“铜与硝酸反应”的实验,以探究化学实验的绿色化.
铜与稀硝酸反应产生NO,NO又被氧化成NO2,对实验观察无色NO有干扰,过多的NO、NO2又会污染环境,改进实验的涉及符合绿色化学的思想.有兴趣小组设计出如图所示装置来改进教材中“铜与硝酸反应”的实验,以探究化学实验的绿色化.
(1)实验前,关闭活塞b,试管d中加水至浸没长导管口,塞紧试管c和d的胶塞,加热c,其目的在于检验装置气密性;
(2)在d中加适量NaOH溶液,c中放一小块铜片,由分液漏斗a向c中加入2mL浓硝酸,c中反应的化学方程式Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O;再由a向c中加2mL蒸馏水,c中实验现象为反应变缓,气体颜色变浅;
(3)表中是制取硝酸铜的三种方案,能体现绿色化学理念的最佳方案是丙,理由是制取等量的硝酸铜时,丙方案耗酸量最少,无污染.
(4)该兴趣小组还用如图装置进行实验证明氧化性KMnO4>Cl2>Br2,操作步骤为向d中加入KBr溶液,c中加入固体KMnO4,由a向c中加入浓盐酸,实验现象为c中有黄绿色气体产生,d中溶液变为橙色,但此实验的不足之处是未处理尾气.
 铜与稀硝酸反应产生NO,NO又被氧化成NO2,对实验观察无色NO有干扰,过多的NO、NO2又会污染环境,改进实验的涉及符合绿色化学的思想.有兴趣小组设计出如图所示装置来改进教材中“铜与硝酸反应”的实验,以探究化学实验的绿色化.
铜与稀硝酸反应产生NO,NO又被氧化成NO2,对实验观察无色NO有干扰,过多的NO、NO2又会污染环境,改进实验的涉及符合绿色化学的思想.有兴趣小组设计出如图所示装置来改进教材中“铜与硝酸反应”的实验,以探究化学实验的绿色化.(1)实验前,关闭活塞b,试管d中加水至浸没长导管口,塞紧试管c和d的胶塞,加热c,其目的在于检验装置气密性;
(2)在d中加适量NaOH溶液,c中放一小块铜片,由分液漏斗a向c中加入2mL浓硝酸,c中反应的化学方程式Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O;再由a向c中加2mL蒸馏水,c中实验现象为反应变缓,气体颜色变浅;
(3)表中是制取硝酸铜的三种方案,能体现绿色化学理念的最佳方案是丙,理由是制取等量的硝酸铜时,丙方案耗酸量最少,无污染.
| 方案 | 反应物 |
| 甲 | Cu、浓硝酸 |
| 乙 | Cu、稀硝酸 |
| 丙 | Cu、O2、稀硝酸 |
14.有一无色透明溶液,欲确定是否含有下列离子:K+、Mg2+、Al3+、Fe2+、Ba2+、NO3-、SO42-Cl-、I-、HCO3-,取该溶液进行如下实验:
由此判断:
(1)溶液中一定存在的离子是NO3-、SO42- Mg2+、Al3+、Cl-_;溶液中肯定不存在的离子是I-、Ba2+、Fe2+、HCO3-.
(2)为进一步确定其他离子,应该补充的实验及对应欲检验离子的名称(若为溶液反应,说明使用
试剂的名称,不必写详细步骤)钾离子;焰色反应.
(3)写出实验⑤中所有反应的离子方程式:H++OH-=H2O;Mg2++2OH-=Mg(OH)2↓;Al3++3OH-=Al(OH)3↓;Al(OH)3+OH-=[Al(OH)4]-.
| 实验步骤 | 实验现象 |
| ①取少量该溶液,加几滴甲基橙溶液 | 溶液变红色 |
| ②取少量该溶液,加铜片和浓硫酸,加热 | 有无色气体产生,遇空气变成红棕色 |
| ③取少量该溶液,加入BaCl2溶液 | 有白色沉淀生成 |
| ④取③中的上层清液,加入AgNO3溶液 | 有不溶于稀硝酸的白色沉淀生成 |
| ⑤取少量该溶液,加入NaOH溶液 | 有白色沉淀生成,当NaOH过量时,沉淀部分溶解 |
(1)溶液中一定存在的离子是NO3-、SO42- Mg2+、Al3+、Cl-_;溶液中肯定不存在的离子是I-、Ba2+、Fe2+、HCO3-.
(2)为进一步确定其他离子,应该补充的实验及对应欲检验离子的名称(若为溶液反应,说明使用
试剂的名称,不必写详细步骤)钾离子;焰色反应.
(3)写出实验⑤中所有反应的离子方程式:H++OH-=H2O;Mg2++2OH-=Mg(OH)2↓;Al3++3OH-=Al(OH)3↓;Al(OH)3+OH-=[Al(OH)4]-.
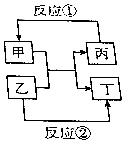 物质甲、乙、丙、丁的相互转化关系如图所反应所示(部分反应物、产物及反应条件已略去),已知甲为常见金属(Na、Mg、Al、Fe、Cu)或其氧化物.回答下列间题:
物质甲、乙、丙、丁的相互转化关系如图所反应所示(部分反应物、产物及反应条件已略去),已知甲为常见金属(Na、Mg、Al、Fe、Cu)或其氧化物.回答下列间题: