题目内容
8.在一定温度下,用水逐渐稀释1mol•L-1氨水的过程中,溶液中随着水量的增加,①n(OH-)增大(填“增大”、“减小”或“不变”,下同);
②$\frac{c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$增大;
③$\frac{c(N{H}_{3}•{H}_{2}O)}{c(N{{H}_{4}}^{+})•c(O{H}^{-})}$不变.
分析 用适量水稀释0.1mol/L氨水时,溶液中随着水量的增加,一水合氨的电离程度增大,则氢氧根离子、铵根离子的物质的量增大,但氢氧根离子的浓度会减小,据此进行判断.
解答 解:①稀释过程中一水合氨的电离程度增大,则氢氧根离子的物质的量增大,故答案为:增大;
②稀释过程中NNH3•H2O的电离程度增大,NNH3•H2O物质的量减小、氢氧根离子的物质的量增大,所以$\frac{c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$ 增大,故答案为:增大;
③一水合氨的电离常数k=$\frac{c(N{{H}_{4}}^{+})•c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$不随浓度的变化而变化,所以$\frac{c(N{H}_{3}•{H}_{2}O)}{c(N{{H}_{4}}^{+})•c(O{H}^{-})}$ 也是一个常数,即不变;
故答案为:不变.
点评 本题考查了弱电解质的电离平衡及其影响,题目难度不大,明确电离平衡及其影响因素为解答关键,注意稀释过程中一水合氨的电离程度增大,试题培养了学生的分析能力及灵活应用能力.

练习册系列答案
 捷径训练检测卷系列答案
捷径训练检测卷系列答案 小夫子全能检测系列答案
小夫子全能检测系列答案
相关题目
16.某化学兴趣小组设计以下实验步骤与操作来定性检验茶叶中含有的少量钙、铁、铝三种元素.
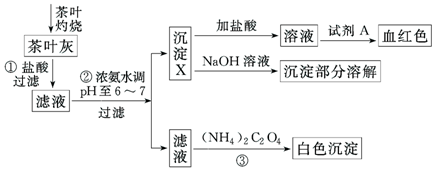
已知Ca2+、Al2+、Fe3+完全形成相应氢氧化物沉淀的pH如下表:
(1)步骤①中加入盐酸的作用是使茶叶中的钙、铁、铝元素转化为离子.
(2)步骤②中调节pH至6~7的目的是使Fe3+、Al3+转化为沉淀.
(3)沉淀X所含主要物质的化学式为Al(OH)3、Fe(OH)3 .
(4)写出沉淀X与NaOH溶液反应的化学方程式Al(OH)3+NaOH=NaAlO2+2H2O;写出步骤③中发生反应的离子方程式:Ca2++C2O42-=CaC2O4↓.
(5)试剂A为硫氰化钾溶液.

已知Ca2+、Al2+、Fe3+完全形成相应氢氧化物沉淀的pH如下表:
| Ca(OH)2 | Al(OH)3 | Fe(OH)3 | |
| pH | ≥13 | ≥5.2 | ≥4.1 |
(2)步骤②中调节pH至6~7的目的是使Fe3+、Al3+转化为沉淀.
(3)沉淀X所含主要物质的化学式为Al(OH)3、Fe(OH)3 .
(4)写出沉淀X与NaOH溶液反应的化学方程式Al(OH)3+NaOH=NaAlO2+2H2O;写出步骤③中发生反应的离子方程式:Ca2++C2O42-=CaC2O4↓.
(5)试剂A为硫氰化钾溶液.
3.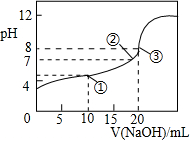 25℃时,向20.00mL0.1mol•L-1HClO2溶液中逐滴加入0.1mol•L-1的NaOH溶液.溶液的pH与滴入NaOH溶液的体积的关系如图所示,则下列说法中不正确的是( )
25℃时,向20.00mL0.1mol•L-1HClO2溶液中逐滴加入0.1mol•L-1的NaOH溶液.溶液的pH与滴入NaOH溶液的体积的关系如图所示,则下列说法中不正确的是( )
 25℃时,向20.00mL0.1mol•L-1HClO2溶液中逐滴加入0.1mol•L-1的NaOH溶液.溶液的pH与滴入NaOH溶液的体积的关系如图所示,则下列说法中不正确的是( )
25℃时,向20.00mL0.1mol•L-1HClO2溶液中逐滴加入0.1mol•L-1的NaOH溶液.溶液的pH与滴入NaOH溶液的体积的关系如图所示,则下列说法中不正确的是( )| A. | ①点时:c(ClO2-)>c(Na+)>c(H+)>c(OH-) | |
| B. | ②点时:c(Na+)=c(ClO2-) | |
| C. | ③点时:c(H+)=c(OH-)+c(HClO2) | |
| D. | 滴定过程中可能出现:c(Na+)>c(ClO2-)>c(OH-)>c(H+) |
8.下列离子方程式书写正确的是( )
| A. | 在强碱溶液中NaClO与Fe(OH)3反应生成Na2FeO4:3ClO-+2Fe(OH)3+4OH-═2FeO42-+3Cl-+5H2O | |
| B. | Fe(OH)3溶于氢碘酸:Fe(OH)3+3H+═Fe3++3H2O | |
| C. | 铜溶于浓硝酸:3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O | |
| D. | 钠与水反应:Na+2H2O═Na++2OH-+H2↑ |
9.某同学查阅教材上的溶解性表时发现,CuCO3对应的为“-”,表示不存在或遇水就分解.已知铜离子的常见沉淀为Cu(OH)2(蓝色)、Cu2(OH)2SO4(蓝色)、Cu2(OH)2CO3(绿色)等,它们均不含结晶水.为了探究CuSO4和Na2CO3反应产物的成份,该同学按以下实验方法制备了两种沉淀,并设计了探究沉淀成份的实验.
取2个小烧杯和2个锥形瓶,在每个烧杯里加入50mL0.5mol/L的CuSO4溶液,在锥形瓶里分别加入40mL 和50mL0.5mol/LNa2CO3溶液,置于70℃水中水浴加热,然后将CuSO4溶液加入到Na2CO3溶液中,继续水浴,均有气泡产生,几分钟后分别得到蓝绿色和绿色沉淀.过滤、洗涤、干燥,得到两份固体.
I.对蓝绿色沉淀成份的探究.
通过右边实验证实,沉淀中含有Cu2(OH)2CO3和Cu2(OH)2SO4

(1)证明有Cu2(OH)2CO3存在的现象为试管2有气泡产生;
(2)试剂①为BaCl2或Ba(NO3)2溶液,证明有Cu2(OH)2SO4存在的现象为试管3有白色沉淀产生.
II.对绿色沉淀成份的探究
重复I实验,发现没有SO42-存在,有Cu2(OH)2CO3存在;
通过下列实验证实,沉淀中只有Cu2(OH)2CO3
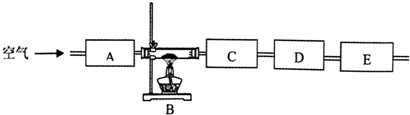
(3)该同学想通过测量固体分解所得气体的质量来确定沉淀的成份,按上述思路组装好装置,加入相应的药品,并指出所加药品的目的.
(4)按照该同学的设计思路,只需测定某两个装置的质量变化,即△m (C):△m(D)=9:22时(括号中填写装置的序号)就可确定固体是Cu2(OH)2CO3.
(5)结论:n(Cu2+):n(CO32-)>1时,所得固体产物有Cu2(OH)2CO3和Cu2(OH)2SO4;n(Cu2+):n(CO32-)≤1时,所得固体产物全部是Cu2(OH)2CO3,生成该沉淀发生反应的离子方程式为:2Cu2++2CO32-+H2O=Cu2(OH)2CO3↓+CO2↑.
取2个小烧杯和2个锥形瓶,在每个烧杯里加入50mL0.5mol/L的CuSO4溶液,在锥形瓶里分别加入40mL 和50mL0.5mol/LNa2CO3溶液,置于70℃水中水浴加热,然后将CuSO4溶液加入到Na2CO3溶液中,继续水浴,均有气泡产生,几分钟后分别得到蓝绿色和绿色沉淀.过滤、洗涤、干燥,得到两份固体.
I.对蓝绿色沉淀成份的探究.
通过右边实验证实,沉淀中含有Cu2(OH)2CO3和Cu2(OH)2SO4

(1)证明有Cu2(OH)2CO3存在的现象为试管2有气泡产生;
(2)试剂①为BaCl2或Ba(NO3)2溶液,证明有Cu2(OH)2SO4存在的现象为试管3有白色沉淀产生.
II.对绿色沉淀成份的探究
重复I实验,发现没有SO42-存在,有Cu2(OH)2CO3存在;
通过下列实验证实,沉淀中只有Cu2(OH)2CO3

(3)该同学想通过测量固体分解所得气体的质量来确定沉淀的成份,按上述思路组装好装置,加入相应的药品,并指出所加药品的目的.
| 仪器 编号 | 药品 | 目的 |
| A | 碱石灰 | |
| B | 绿色固体 | |
| C | ||
| D | ||
| E | 碱石灰 |
(5)结论:n(Cu2+):n(CO32-)>1时,所得固体产物有Cu2(OH)2CO3和Cu2(OH)2SO4;n(Cu2+):n(CO32-)≤1时,所得固体产物全部是Cu2(OH)2CO3,生成该沉淀发生反应的离子方程式为:2Cu2++2CO32-+H2O=Cu2(OH)2CO3↓+CO2↑.
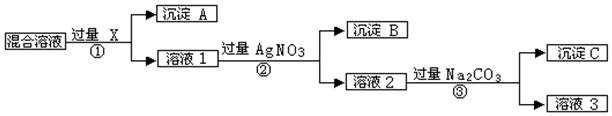
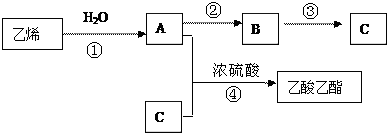
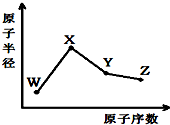 W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如图.已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的非金属性在同周期元素中最强.回答下列问题:
W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如图.已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的非金属性在同周期元素中最强.回答下列问题: .
.