题目内容
类比推断法是研究物质性质的常用方法之一,可预测许多物质的性质.但类比推断法是相对的,不能违背客观实际.下列说法正确的是( )
| A、由溶解性CaCO3<Ca(HCO3)2,则溶解性Na2CO3<NaHCO3 |
| B、向Ca(ClO)2溶液中通入少量CO2可得到CaCO3,则向Ca(ClO)2溶液中通入少量SO2可得到CaSO3 |
| C、由O2与Li加热生成Li2O,则O2与Na加热生成Na2O |
| D、有Fe与S加热生成FeS,则Cu与S加热生成Cu2S |
考点:难溶电解质的溶解平衡及沉淀转化的本质,氯、溴、碘及其化合物的综合应用,二氧化硫的化学性质,碱金属的性质,铁的化学性质
专题:元素及其化合物
分析:A、相同条件下,Na2CO3的溶解度大于NaHCO3;
B、二氧化硫具有还原性,次氯酸钙具有强氧化性,二氧化硫和次氯酸钙会发生氧化还原反应,生成产物为硫酸钙,氯化钙;
C、O2与Li加热生成Li2O,但O2与Na在常温下生成氧化钠,加热生成过氧化钠;
D、S的氧化性很弱,S单质和金属反应,只能生成低价金属化合物.
B、二氧化硫具有还原性,次氯酸钙具有强氧化性,二氧化硫和次氯酸钙会发生氧化还原反应,生成产物为硫酸钙,氯化钙;
C、O2与Li加热生成Li2O,但O2与Na在常温下生成氧化钠,加热生成过氧化钠;
D、S的氧化性很弱,S单质和金属反应,只能生成低价金属化合物.
解答:
解:A、相同条件下,Na2CO3的溶解度大于NaHCO3,CaCO3的溶解度小于Ca(HCO3)2,故A错误;
B、二氧化硫具有还原性,次氯酸钙具有强氧化性,二氧化硫和次氯酸钙会发生氧化还原反应,生成产物为硫酸钙,氯化钙,故B错误;
C、O2与Li加热生成Li2O,但O2与Na在常温下生成氧化钠,加热生成过氧化钠,故C错误;
D、硫的氧化性比氧气、氯气弱,只能把金属氧化到低价. Fe的低价为+2价;Cu的低价为+1价,Fe+S
FeS; 2Cu+S
Cu2S,故D正确;
故选D.
B、二氧化硫具有还原性,次氯酸钙具有强氧化性,二氧化硫和次氯酸钙会发生氧化还原反应,生成产物为硫酸钙,氯化钙,故B错误;
C、O2与Li加热生成Li2O,但O2与Na在常温下生成氧化钠,加热生成过氧化钠,故C错误;
D、硫的氧化性比氧气、氯气弱,只能把金属氧化到低价. Fe的低价为+2价;Cu的低价为+1价,Fe+S
| ||
| ||
故选D.
点评:本题考查物质的性质,涉及物质的溶解性、氧化还原反应、硫的弱氧化性以及反应产物受条件的影响,注意类比分析解答,把握物质的特性为解答的关键,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
Al2O3是刚玉的主要成分,Al2O3属于( )
| A、酸 | B、氧化物 | C、碱 | D、单质 |
下列事实与胶体知识有关的是( )
①用盐卤制豆腐
②用明矾净水
③河海交接处易形成沙洲
④一支钢笔使用不同牌号的蓝黑墨水易堵塞
⑤工厂静电除尘.
①用盐卤制豆腐
②用明矾净水
③河海交接处易形成沙洲
④一支钢笔使用不同牌号的蓝黑墨水易堵塞
⑤工厂静电除尘.
| A、①②⑤ | B、①③④⑤ |
| C、①②③④⑤ | D、都无关 |
下列说法不正确的是 ( )
| A、用稀盐酸洗涤AgCl沉淀比用水洗涤损耗AgCl小 |
| B、物质的溶解度随温度的升高而增加,故物质的溶解都是吸热的 |
| C、对于Al(OH)3(s)?Al(OH)3(aq)?Al3++3OH-,前者为溶解平衡,后者为电离平衡 |
| D、除溶液中的Mg2+,用OH-沉淀Mg2+比用CO32-效果好,说明Mg(OH)2的溶解度比MgCO3大 |
| E、沉淀反应中常加过量的沉淀剂,其目的是使沉淀完全 |
下列叙述正确的是( )
| A、25℃时,MgCO3饱和溶液中c(Mg2+)=2.6×10-3mol?L-1,CaCO3饱和溶液中c(Ca2+)=5.3×10-5mol?L-1,向浓度均为0.1 mol?L-1的MgCl2和CaCl2混合溶液中逐滴加入0.1 mol?L-1的Na2CO3溶液,首先生成 CaCO3沉淀 |
| B、0.1 mol/LNa2CO3溶液和0.1 mol/L NaHSO4溶液等体积混合,溶液中c(Na+)+c(H+)=c(CO32-)+c(SO42-)+c(HCO3-)+c(OH-) |
| C、pH=3的醋酸和pH=11的NaOH溶液等体积混合后,pH>7 |
| D、已知Fe3++2 I-=Fe2++I2,则浓度和体积相同的FeBr2、FeI2溶液中,分别通入少量氯气后都首先发生置换反应 |
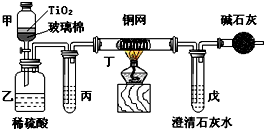 电镀厂曾采用有氰电镀工艺,由于排放的废水中含有的剧毒CN-离子,而逐渐被无氰电镀工艺替代.处理有氰电镀的废水时,可在催化剂TiO2作用下,先用NaClO将CN-离子氧化成CNO-,再在酸性条件下继续被NaClO氧化成N2和CO2.环保工作人员在密闭系统中用下图装置进行实验,以证明处理方法的有效性,并测定CN-被处理的百分率.将浓缩后含CN-离子的污水与过量NaClO溶液的混合液共200mL(其中CN-的浓度为0.05mol?L-1)倒入甲中,塞上橡皮塞,一段时间后,打开橡皮塞和活塞,使溶液全部放入乙中,关闭活塞.回答下列问题:
电镀厂曾采用有氰电镀工艺,由于排放的废水中含有的剧毒CN-离子,而逐渐被无氰电镀工艺替代.处理有氰电镀的废水时,可在催化剂TiO2作用下,先用NaClO将CN-离子氧化成CNO-,再在酸性条件下继续被NaClO氧化成N2和CO2.环保工作人员在密闭系统中用下图装置进行实验,以证明处理方法的有效性,并测定CN-被处理的百分率.将浓缩后含CN-离子的污水与过量NaClO溶液的混合液共200mL(其中CN-的浓度为0.05mol?L-1)倒入甲中,塞上橡皮塞,一段时间后,打开橡皮塞和活塞,使溶液全部放入乙中,关闭活塞.回答下列问题: 大气中的部分碘源于O3对海水中I-的氧化.将O3持续通入NaI酸性溶液溶液中进行模拟研究.
大气中的部分碘源于O3对海水中I-的氧化.将O3持续通入NaI酸性溶液溶液中进行模拟研究.
 如图把混合气体缓慢通过盛有足量试剂的试剂瓶A,在试管B中可以观察到明显现象的是( )
如图把混合气体缓慢通过盛有足量试剂的试剂瓶A,在试管B中可以观察到明显现象的是( )