题目内容
3.叠氮化钠(NaN3)是一种无色晶体,易溶于水,微溶于乙醇,不溶于乙醚,广泛应用于汽车安全气囊.某硝酸工厂拟通过下列方法处理尾气并制备叠氮化钠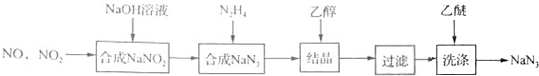
(1)物质的量之比1:1的NO和NO2混合气体与NaOH溶液反应的化学方程式为NO+NO2+2NaOH=2NaNO2+H2O.
(2)结晶时加入乙醇的目的是降低NaN3的溶解度使其析出;用乙醚洗涤的目的是减少晶体的损失.
(3)汽车剧烈碰撞时,安全气囊中发生反应:10NaN3+2KNO3$\frac{\underline{\;撞击\;}}{\;}$K2O+5Na2O+16N2↑.假定汽车中某个安全气囊容积为44.8L.
①标出上述反应的电子转移方向及数目
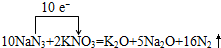 .
.②欲使气囊中充满标准状况下氮气,则该安全气囊至少应装入KNO3的质量多少克?(写出计算过程,不考虑固体的体积).
分析 (1)物质的量之比1:1的NO和NO2混合气体与NaOH溶液反应,发生氧化还原反应生成NaNO2;
(2)由信息可知,NaN3是一种无色晶体,易溶于水,微溶于乙醇,不溶于乙醚,以此分析;
(3)①只有N元素的化合价变化,氧化还原反应中,化合价降低值=化合价升高值=转移电子数,据此表示电子转移情况;
②安全气囊容积为56L,气囊中充满标准状况下氮气,氮气的物质的量为$\frac{56L}{22.4L/mol}$=2.5mol,结合10NaN3+2KNO3$\frac{\underline{\;撞击\;}}{\;}$K2O+5Na2O+16N2↑及m=nM计算.
解答 解:(1)物质的量之比1:1的NO和NO2混合气体与NaOH溶液反应,发生氧化还原反应生成NaNO2,由电子及原子守恒可知反应为NO+NO2+2NaOH=2NaNO2+H2O,
故答案为:NO+NO2+2NaOH=2NaNO2+H2O;
(2)由信息可知,NaN3是一种无色晶体,易溶于水,微溶于乙醇,不溶于乙醚,则结晶时加入乙醇的目的是降低NaN3的溶解度使其析出;用乙醚洗涤的目的是减少晶体的损失防止晶体溶解,
故答案为:降低NaN3的溶解度使其析出;减少晶体的损失;
(3)①只有N元素的化合价变化,氧化还原反应中,化合价降低值=化合价升高值=转移电子数,由N元素的化合价降低可知,该反应转移10e-,则电子转移情况为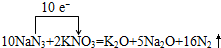 ,
,
故答案为: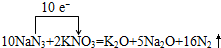 ;
;
②安全气囊容积为56L,气囊中充满标准状况下氮气,氮气的物质的量为$\frac{56L}{22.4L/mol}$=2.5mol,由10NaN3+2KNO3$\frac{\underline{\;撞击\;}}{\;}$K2O+5Na2O+16N2↑可知,需要NaN3和KNO3的物质的量分别为2.5mol×$\frac{10}{16}$、2.5mol×$\frac{2}{16}$,则安全气囊应装入NaN3和KNO3的总质量为2.5mol×$\frac{10}{16}$×65g/mol+2.5mol×$\frac{2}{16}$×101g/mol=133.1g,
答:安全气囊应装入NaN3和KNO3的总质量为133.1g.
点评 本题以物质的制备考查氧化还原反应及计算、混合物分离提纯等,注重高频考点的考查,侧重化学反应原理应用及计算能力的考查,题目难度中等.

 寒假学与练系列答案
寒假学与练系列答案| A. | 利用高纯硅的半导体性能可制成光电池 | |
| B. | 利用煤的气化可获得洁净的燃料 | |
| C. | 利用明矾水解产物的两性可用于净水 | |
| D. | 利用浸泡过高锰酸钾溶液的硅土吸收乙烯可使水果保鲜 |
| A. | 6.4g | B. | 9.6g | C. | 11.2g | D. | 12.8g |
2H2(g)+O2(g)═2H2O(g)△H=-483.6kJ•mol-1
CH4(g)+2O2(g)═CO2(g)+2H2O(1)△H=-890.31kJ•mol-1
下列说法正确的是( )
| A. | 根据上述热化学方程式可以确定H2、CH4的燃烧热 | |
| B. | H2(g)+$\frac{1}{2}$O2(g)═H2O(1)△H=-241.8kJ•mol-1 | |
| C. | CH4(g)+$\frac{3}{2}$O2(g)═CO(g)+2H2O(g)△H>-890.31kJ•mol-1 | |
| D. | 8gCH4完全燃烧释放出的热量为445.155kJ |
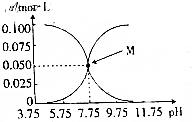 常温下,有c(HCN)+c(CN-)=0.1mol•L-1的氢氰酸、氰化钠的混合溶液,溶液中c(HCN)、c(CN-)与pH的关系如图所示,下列叙述错误的是( )
常温下,有c(HCN)+c(CN-)=0.1mol•L-1的氢氰酸、氰化钠的混合溶液,溶液中c(HCN)、c(CN-)与pH的关系如图所示,下列叙述错误的是( )| A. | 在pH=8.75的该溶液中:c(CN-)>c(HCN)>c(OH-)>c(H+) | |
| B. | 在M点所表示的溶液中:c(Na+)+c(H+)=c(HCN)+c(OH-) | |
| C. | 该溶液呈酸性、碱性或中性时,始终有:c(Na+)+c(H+)+c(OH-)-c(HCN)=0.1mol•L-1 | |
| D. | 该溶液中当c(HCN)=c(CN-)时,盐的水解程度大于酸的电离程度 |
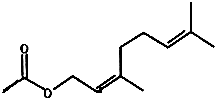
| A. | 分子式为C12H20O2 | |
| B. | 它的同分异构体中不可能有酚类 | |
| C. | 其一氯化物共7种 | |
| D. | 1mol该有机物与1mol水在一定条件下反应可能的产物有6种 |
| A. | 向NaAlO2溶液中滴入NaHCO3溶液有白色沉淀,原因是二者可以发生双水解反应 | |
| B. | 电解精炼铜时,若阴极得到1.204×1024个电子,则阳极质量减少6.4g | |
| C. | 使甲基橙变红色溶液:Mg2+、K+、SO42-、NO3-能大量共存 | |
| D. | Na2S在空气中长期放置变浑浊的离子方程式为:2S2-+O2+4H+=2S+2H2O |
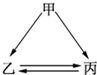 如图所示的甲、乙、丙三种物质均含有相同的某种元素,箭头表示物质间的转化一步就能实现,则甲可能是( )
如图所示的甲、乙、丙三种物质均含有相同的某种元素,箭头表示物质间的转化一步就能实现,则甲可能是( )①Fe; ②HNO3; ③Na; ④C; ⑤Al.
| A. | ①②③⑤ | B. | ②③④⑤ | C. | ①②③④ | D. | ①②③④⑤ |
| A. | 含有AgCl和AgI固体的悬浊液:c(Ag+)>c(C1-)=c(I-) | |
| B. | CO2的水溶液:c(H+)>c(HCO3-)═2c(CO32-) | |
| C. | pH=1的NaHSO4溶液:c(H+)=c(SO42-)十c(OH-) | |
| D. | 含等物质的量的NaHC2O4和Na2C2O4的溶液:3c(Na+)═2[c(HC2O4-)+c(C2O42-)+c(H2C2O4)] |