题目内容
14.将一定质量的铜溶于50mL 11mol/L的浓硝酸中,待铜完全溶解后,生成0.2mol NO2和NO的混合气体,并测得溶液中H+的浓度为1mol/L.假设反应后溶液的体积仍为50mL,则金属铜的质量为( )| A. | 6.4g | B. | 9.6g | C. | 11.2g | D. | 12.8g |
分析 被还原的硝酸生成NO2、NO混合物,根据N原子守恒可知,被还原的n(HNO3)=n(NO2+NO);反应中硝酸有剩余,根据氢离子计算剩余硝酸物质的量,再根据N元素守恒计算Cu(NO3)2的物质的量,根据Cu元素守恒计算Cu的质量.
解答 解:被还原的硝酸生成NO2或NO2、NO混合物,根据N原子守恒可知,故被还原的n(HNO3)=n(气体)=0.20mol,
剩余的n(HNO3)=1.0 mol•L-1×0.05L=0.05 mol,
根据N元素守恒,可知0.05mol+0.2mol+2n[Cu(NO3)2]=11.0 mol•L-1×0.050L,
解得n[Cu(NO3)2]=0.15mol,
故m(Cu)=0.15mol×64g.mol-1=9.6g,
故选B.
点评 本题考查化学方程式计算、氧化还原反应计算,难度中等,注意反应中硝酸起氧化剂、还原剂作用,注意守恒思想的应用.

练习册系列答案
 考前必练系列答案
考前必练系列答案
相关题目
4.为实现下列实验目的,依据如表提供的主要仪器、所用试剂不合理的是( )
| 选项 | 实验目的 | 主要仪器 | 试剂 |
| A | 分离Br2和CCl4的混合物 | 分液漏斗、烧杯 | Br2和CCl4的混合物、蒸馏水 |
| B | 制备Fe(OH)3胶体 | 烧杯、玻璃棒、酒精灯 | 1.0mol/L FeCl3溶液、蒸馏水 |
| C | 实验室制取NH3 | 试管、带导管的橡皮塞 | 浓氨水、生石灰 |
| D | 测定NaOH溶液浓度 | 滴定管、锥形瓶、烧杯 | NaOH溶液、0.100 0mol/L盐酸、酚酞溶液 |
| A. | A | B. | B | C. | C | D. | D |
5.NA为阿伏加罗常数的值,下列有关计算正确的是( )
| A. | 标准状况下,22.4LCHCl3中含有的氯原子数目为3NA | |
| B. | 46g二氧化氮含有的原子总数一定为3NA | |
| C. | 5NH4NO3$\frac{\underline{\;\;△\;\;}}{\;}$2NHO3+4N2↑+9H2O该反应生成28gN2时,转移的电子数目为4NA | |
| D. | 在密闭容器中加入1,5molH2和0.5molN2,充分反应后可得到NH3分子数为NA |
2.下列关于HClO的说法不正确的是( )
| A. | HClO是强酸 | B. | HClO不稳定 | ||
| C. | HClO是强氧化性酸 | D. | HClO能杀菌消毒 |
9.在下列各溶液中,离子一定能大量共存的是( )
| A. | 强碱性溶液中:K+、Na+、Cl-、SO42- | |
| B. | 含有0.1mol•L-1Fe3+的溶液中:K+、Mg2+、SCN-、NO3- | |
| C. | 澄清透明的无色溶液:ClO-、MnO4-、Al3+、S2- | |
| D. | 室温下,pH=1的溶液中:Na+、ClO-、NO3-、SO42- |
19.下列说法正确的是( )
| A. | 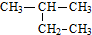 与 与 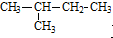 互为同分异构体 互为同分异构体 | |
| B. | 红磷与白磷互为同素异形体 | |
| C. | CH3CH2OH与HOCH2CH2CH2OH互为同系物 | |
| D. | 35Cl与37Cl为同一种核素 |
11.下列实验能达到目的是( )
| A. | 加入盐酸以除去硫酸钠中少量的碳酸钠杂质 | |
| B. | 用玻璃棒搅拌漏斗中的液体以加快反应速率 | |
| C. | 用稀硫酸和锌反应制氢气时加入少许硫酸铜以加快反应速率 | |
| D. | 在容量瓶中加入一定体积的水,再加入浓硫酸配制准确浓度的稀硫酸 |
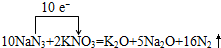 .
.