题目内容
(1)氨与灼热的氧化铜反应,生成Cu、N2和H2O.
①写出反应的化学方程式并用单线桥法表示电子转移的方向和数目 ,该反应的氧化产物是 .
②当17g还原剂发生反应时,消耗氧化剂的质量为 ;转移的电子物质的量为 mol.
(2)在反应RO3n-+6I-+6H+=R-+3I2+3H2O中,①RO3n-中R元素的化合价为 ,n的数值为 .
②该反应中RO3n-得到的电子数为 .
①写出反应的化学方程式并用单线桥法表示电子转移的方向和数目
②当17g还原剂发生反应时,消耗氧化剂的质量为
(2)在反应RO3n-+6I-+6H+=R-+3I2+3H2O中,①RO3n-中R元素的化合价为
②该反应中RO3n-得到的电子数为
考点:氧化还原反应
专题:氧化还原反应专题
分析:(1)氨与灼热的氧化铜反应,生成Cu、N2和H2O,则反应为3CuO+2NH3
3Cu+N2+3H2O,Cu元素化合价由+2价降低到0价,被还原,N元素化合价由-3价升高到0价,被氧化,结合化合价的变化判断电子的转移以及方程式的计算;
(2)RO3n-+6I-+6H+=R-+3I2+3H2O中,由电荷守恒可知,n=1,RO3n-离子中化合价的代数和为-1,R元素的化合价由+5价降低为-1价,以此来解答.
| ||
(2)RO3n-+6I-+6H+=R-+3I2+3H2O中,由电荷守恒可知,n=1,RO3n-离子中化合价的代数和为-1,R元素的化合价由+5价降低为-1价,以此来解答.
解答:
解:(1)①氨与灼热的氧化铜反应,生成Cu、N2和H2O,则反应为3CuO+2NH3
3Cu+N2+3H2O,Cu元素化合价由+2价降低到0价,被还原,N元素化合价由-3价升高到0价,被氧化,N2为氧化产物;反应中Cu元素得电子,化合价降低,N元素失电子,化合价升高,转移电子数目为6,电子转移的方向和数目可表示为 ,故答案为:
,故答案为: ;N2;
;N2;
②17g还原剂发生反应时,即氨气的物质的量为1mol,消耗氧化剂的质量为1.5mol×80g/mol=120g,转移电子为1mol×2×(3-0)=6mol,故答案为:120g;6;
(2)①RO3n-+6I-+6H+=R-+3I2+3H2O中,由电荷守恒可知,n=1,RO3n-离子中化合价的代数和为-1,则R元素的化合价为-1-(-2)×3=+5,故答案为:+5;1;
②由R元素的化合价变化可知,该反应中RO3n-得到的电子数为5-(-1)=6,故答案为:6.
| ||
 ,故答案为:
,故答案为: ;N2;
;N2;②17g还原剂发生反应时,即氨气的物质的量为1mol,消耗氧化剂的质量为1.5mol×80g/mol=120g,转移电子为1mol×2×(3-0)=6mol,故答案为:120g;6;
(2)①RO3n-+6I-+6H+=R-+3I2+3H2O中,由电荷守恒可知,n=1,RO3n-离子中化合价的代数和为-1,则R元素的化合价为-1-(-2)×3=+5,故答案为:+5;1;
②由R元素的化合价变化可知,该反应中RO3n-得到的电子数为5-(-1)=6,故答案为:6.
点评:本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重氧化还原反应基本概念和转移电子的考查,注意电子守恒、电荷守恒的应用,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
汽水是CO2的饱和溶液,其中存在如下平衡H2CO3?H++HCO
…①HCO
?H++CO
…②将汽水倒入试管中分别进行下列实验,相应分析结论错误的是( )
- 3 |
- 3 |
2- 3 |
| A、加热、平衡①、②可能都向左移动 |
| B、加入澄清石灰水,平衡①、②均向右移动 |
| C、加入CaCO3悬浊液,CaCO3的溶解平衡向正方向移动 |
| D、通入过量CO2或滴加氯水,溶液PH均减小 |
下列离子方程式正确的是( )
| A、NaHSO3溶液中投入过氧化钠粉末:4HSO3-+2Na2O2═4SO32-+O2↑+4Na+ |
| B、Na2O2与水反应:2O22-+2H2O═4OH-+O2↑ |
| C、向FeBr2溶液中通入少量Cl2:2Fe2++Cl2═2Fe3++2Cl- |
| D、向次氯酸钙溶液中通入过量CO2:Ca2++2ClO-+CO2+H2O═CaCO3↓+2HClO |
 ,根据下列叙述,填写以下内容:
,根据下列叙述,填写以下内容: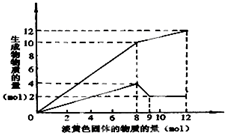 某溶液中可能含有Fe2+、Mg2+、Cu2+、NH4+、Al3+中的一种或几种.当加入一种淡黄色固体并加热溶液时,有刺激性气体放出和白色沉淀生成,加入淡黄色固体的物质的量(横坐标)与析出沉淀和产生气体的物质的量(纵坐标)的关系,如图所示.请填写下列空白:
某溶液中可能含有Fe2+、Mg2+、Cu2+、NH4+、Al3+中的一种或几种.当加入一种淡黄色固体并加热溶液时,有刺激性气体放出和白色沉淀生成,加入淡黄色固体的物质的量(横坐标)与析出沉淀和产生气体的物质的量(纵坐标)的关系,如图所示.请填写下列空白: