题目内容
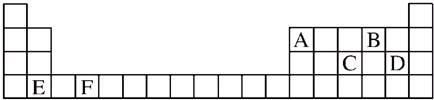
(1)A、B、C、D、E、F是元素周期表前四周期的元素,它们在元素周期表中的位置如图所示:
①写出F的基态原子的核外电子排布式: .
B原子的核外电子排布的轨道表示式 .
②C元素的第一电离能比同周期相邻的两种元素的第一电离能都高的原因是 .
(2)A、B、C 3种元素中,A的第一电离能最小,B的电负性最大,3种元素的失电子能力由强到弱的顺序为
.
(3)D、E两种元素形成的化合物化学式为 .

①写出F的基态原子的核外电子排布式:
B原子的核外电子排布的轨道表示式
②C元素的第一电离能比同周期相邻的两种元素的第一电离能都高的原因是
(2)A、B、C 3种元素中,A的第一电离能最小,B的电负性最大,3种元素的失电子能力由强到弱的顺序为
(3)D、E两种元素形成的化合物化学式为
考点:元素周期律和元素周期表的综合应用
专题:元素周期律与元素周期表专题
分析:由元素在周期表中位置,可知A为硼、B为氧、C为磷、D为Cl、E为Ca、F为Ti.
(1)①F为Ti,原子核外电子数为22,根据能量最低原理书写核外电子排布;B为O元素,原子核外电子排布为1s22s22p4,结合核外电子排布规律画出其轨道排布图;
②P原子3p能级容纳3个电子,为半满稳定状态,能量较低;
(2)第一电离能越小,越容易失去电子,电负性越大越容易获得电子;
(3)D、E两种元素形成的化合物为氯化钙.
(1)①F为Ti,原子核外电子数为22,根据能量最低原理书写核外电子排布;B为O元素,原子核外电子排布为1s22s22p4,结合核外电子排布规律画出其轨道排布图;
②P原子3p能级容纳3个电子,为半满稳定状态,能量较低;
(2)第一电离能越小,越容易失去电子,电负性越大越容易获得电子;
(3)D、E两种元素形成的化合物为氯化钙.
解答:
解:由元素在周期表中位置,可知A为硼、B为氧、C为磷、D为Cl、E为Ca、F为Ti.
(1)①F为Ti,原子核外电子数为22,由能量最低原理,其核外电子排布为:1s22s22p63s23p63d24s2;
B为O元素,原子核外电子排布为1s22s22p4,其轨道排布图为: ,
,
故答案为:1s22s22p63s23p63d24s2; ;
;
②磷原子的最外层电子排布式3s23p3,3p能级容纳3个电子,它处于半充满稳定状态,能量较低,第一电离能高于同周期相邻元素
故答案为:磷原子的最外层电子排布式3s23p3,3p能级容纳3个电子,它处于半充满稳定状态,能量较低;
(2)B、P、O 3种元素中,B的第一电离能最小,O的电负性最大,第一电离能越小,越容易失去电子,电负性越大越容易获得电子,故失去电子能力:B>P>O,故答案为:B>P>O;
(3)D、E两种元素形成的化合物为氯化钙,化学式为CaCl2,故答案为:CaCl2.
(1)①F为Ti,原子核外电子数为22,由能量最低原理,其核外电子排布为:1s22s22p63s23p63d24s2;
B为O元素,原子核外电子排布为1s22s22p4,其轨道排布图为:
 ,
,故答案为:1s22s22p63s23p63d24s2;
 ;
;②磷原子的最外层电子排布式3s23p3,3p能级容纳3个电子,它处于半充满稳定状态,能量较低,第一电离能高于同周期相邻元素
故答案为:磷原子的最外层电子排布式3s23p3,3p能级容纳3个电子,它处于半充满稳定状态,能量较低;
(2)B、P、O 3种元素中,B的第一电离能最小,O的电负性最大,第一电离能越小,越容易失去电子,电负性越大越容易获得电子,故失去电子能力:B>P>O,故答案为:B>P>O;
(3)D、E两种元素形成的化合物为氯化钙,化学式为CaCl2,故答案为:CaCl2.
点评:本题是对物质结构的考查,涉及核外电子排布、电离能、电负性等,难度不大,注意理解同周期元素中第一电离能突跃原因,理解电离能与元素化合价关系.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
下列离子方程式,错误的是( )
| A、碳酸钙与盐酸反应:CaCO3+2H+═Ca2++CO2↑+H2O |
| B、钠投入水中:Na+H2O═Na++OH-+H2↑ |
| C、钠投入硫酸铜溶液中:2Na+Cu2+═Cu+2Na+ |
| D、铁粉加入到FeCl3溶液中:Fe+2Fe3+═3Fe2+ |
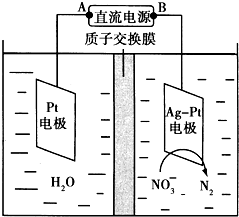 化学在环境保护中起着十分重要的作用.催化反硝化法和电化学降解法可用于治理水中硝酸盐的污染.
化学在环境保护中起着十分重要的作用.催化反硝化法和电化学降解法可用于治理水中硝酸盐的污染.