题目内容
电化学问题:该大题共3个小题,请按要求回答下列各小题中的问题.
(1)镍镉(Ni-Cd)可充电电池在现代生活中有广泛应用,其充、放电反应按下式进行:Cd(OH)2+2Ni(OH)2
Cd+2NiO(OH)+2H2O,该电池中的电解质溶液显 性(填写“酸性”、“中性”或“碱性”),当该电池放电时,正极上发生的电极反应式是 .
(2)如图1是以石墨为电极电解CuCl2溶液的装置示意图.

①电解过程中,a电极为 极,该电极上发生的电极反应式应为 .
②电解一段时间后,b电极上可观察到的现象是 .
③电解过程中能量转化的主要形式是 .
(3)图2是用石墨和铁作电极电解饱和食盐水的装置.为了防止副反应的进行,工业上电解饱和食盐水的方法之一,是将两个极室用阳离子交换膜隔开(如图3),原料饱和食盐水应从 处加入(填字母“A”或“B”).阳离子交换膜只允许 离子通过.若采用无隔膜电解食盐水,Cl2和NaOH充分接触,产物仅是NaClO和H2,则电解过程的总反应化学方程式为 .
(1)镍镉(Ni-Cd)可充电电池在现代生活中有广泛应用,其充、放电反应按下式进行:Cd(OH)2+2Ni(OH)2
| 充电 |
| 放电 |
(2)如图1是以石墨为电极电解CuCl2溶液的装置示意图.

①电解过程中,a电极为
②电解一段时间后,b电极上可观察到的现象是
③电解过程中能量转化的主要形式是
(3)图2是用石墨和铁作电极电解饱和食盐水的装置.为了防止副反应的进行,工业上电解饱和食盐水的方法之一,是将两个极室用阳离子交换膜隔开(如图3),原料饱和食盐水应从
考点:电解原理,原电池和电解池的工作原理
专题:电化学专题
分析:(1)该装置放电时为原电池、充电时为电解池,负极反应为Cd-2e-+2OH-=Cd(OH)2,正极上反应式为:NiOOH+e-+H2O═Ni(OH)2+OH-,充电时阳极上发生的电极反应和正极反应互为逆过程,阴极上发生的电极和负极反应互为逆过程,以此解答该题;
(2)电解池中,和电源的正极相连的是阳极,该极上是失电子的氧化反应,和电源的负极相连的是阴极,该极上发生还原反应,根据电解池的能量转化来回答;
(3)用惰性电极电解饱和食盐水时,阳极上氯离子放电生成氯气,且使用阳离子交换膜,只有阳离子能通过交换膜,则原料饱和食盐水从A处加入;阳离子交换膜只有阳离子能被允许通过;若采用无隔膜电解食盐水,Cl2和NaOH充分接触,产物仅是NaClO和H2,则阳极上氯离子放电生成次氯酸钠、阴极上氢离子放电,据此分析解答.
(2)电解池中,和电源的正极相连的是阳极,该极上是失电子的氧化反应,和电源的负极相连的是阴极,该极上发生还原反应,根据电解池的能量转化来回答;
(3)用惰性电极电解饱和食盐水时,阳极上氯离子放电生成氯气,且使用阳离子交换膜,只有阳离子能通过交换膜,则原料饱和食盐水从A处加入;阳离子交换膜只有阳离子能被允许通过;若采用无隔膜电解食盐水,Cl2和NaOH充分接触,产物仅是NaClO和H2,则阳极上氯离子放电生成次氯酸钠、阴极上氢离子放电,据此分析解答.
解答:
解:(1)当该电池放电时,正极发生还原反应,由总反应式可知Ni元素化合价降低,被还原,应为正极反应,电极方程式为NiO(OH)+H2O+e-═Ni(OH)2+OH-,反应有参加OH-,电解质溶液应呈碱性.
故答案为:碱;NiO(OH)+H2O+e-═Ni(OH)2+OH-.
(2)①电解池中,a电极和电源正极相连,为阳极,该极上是氯离子失电子的氧化反应,即2Cl--2e-═Cl2↑,故答案为:阳;2Cl--2e-═Cl2↑;
②电解氯化铜,和电源的负极相连的是阴极,该极上是铜离子得电子,析出金属铜,故答案为:析出红色固体;
③电解池是将电能转化为化学能的装置,故答案为:电能转化为化学能;
(3)用惰性电极电解饱和食盐水时,阳极上Cl-放电生成Cl2,阴极上H+放电生成H2,且使用阳离子交换膜,只有阳离子能通过交换膜,则原料饱和食盐水从A处加入,B处加入稀的碱溶液;阳离子交换膜只有阳离子能被允许通过;若采用无隔膜电解食盐水,Cl2和NaOH充分接触,产物仅是NaClO和H2,则阳极上氯离子放电生成次氯酸钠、阴极上氢离子放电,电池反应式为NaCl+H2O
NaClO+H2↑,
故答案为:A;阳;NaCl+H2O
NaClO+H2↑.
故答案为:碱;NiO(OH)+H2O+e-═Ni(OH)2+OH-.
(2)①电解池中,a电极和电源正极相连,为阳极,该极上是氯离子失电子的氧化反应,即2Cl--2e-═Cl2↑,故答案为:阳;2Cl--2e-═Cl2↑;
②电解氯化铜,和电源的负极相连的是阴极,该极上是铜离子得电子,析出金属铜,故答案为:析出红色固体;
③电解池是将电能转化为化学能的装置,故答案为:电能转化为化学能;
(3)用惰性电极电解饱和食盐水时,阳极上Cl-放电生成Cl2,阴极上H+放电生成H2,且使用阳离子交换膜,只有阳离子能通过交换膜,则原料饱和食盐水从A处加入,B处加入稀的碱溶液;阳离子交换膜只有阳离子能被允许通过;若采用无隔膜电解食盐水,Cl2和NaOH充分接触,产物仅是NaClO和H2,则阳极上氯离子放电生成次氯酸钠、阴极上氢离子放电,电池反应式为NaCl+H2O
| ||
故答案为:A;阳;NaCl+H2O
| ||
点评:本题考查原电池和电解池原理、电极反应式的书写,明确电极上得失电子及反应物质是解本题关键,电极反应式的书写是学习难点,要注意结合电解质溶液的酸碱性书写,难度中等.

练习册系列答案
相关题目
按照绿色化学的原则,最理想的“原子经济”就是反应物的原子全部转化为期望的最终产物.下列生产乙醇的反应中,原子利用率最高的是( )
A、乙烯水化:CH2=CH2+H2O
| |||
B、葡萄糖发酵:C6H12O6
| |||
C、溴乙烷水解:CH3CH2Br+H2O
| |||
D、丙酸乙酯水解:CH3CH2COOCH2CH3+H2O
|
化学与工农业生产、环境保护、日常生活等方面有广泛联系,下列叙述错误的是( )
| A、绿色化学的核心是利用化学原理从源头上减少和消除工业生产对环境的污染 |
| B、“84”消毒液的有效成分为NaClO,能杀菌消毒 |
| C、某雨水放置一段时间后,pH由4.68变为4.28,是因为雨水在放置过程中溶解了较多的CO2 |
| D、高纯度的二氧化硅广泛用于制作光导纤维,光导纤维遇强碱会“断路” |
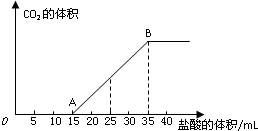 将一定体积的CO2通入到50mL某浓度的NaOH溶液中,得到溶液甲.为了测定其溶液甲的成分,向该溶液甲中加入1mol/L的盐酸,所加入的盐酸与产生CO2的体积(标况)的关系如图所示:
将一定体积的CO2通入到50mL某浓度的NaOH溶液中,得到溶液甲.为了测定其溶液甲的成分,向该溶液甲中加入1mol/L的盐酸,所加入的盐酸与产生CO2的体积(标况)的关系如图所示: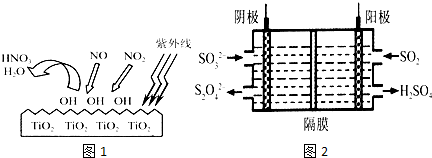
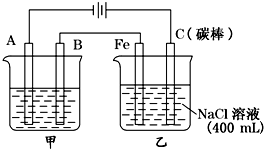 如图为相互串联的甲乙两电解池
如图为相互串联的甲乙两电解池