题目内容
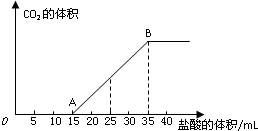 将一定体积的CO2通入到50mL某浓度的NaOH溶液中,得到溶液甲.为了测定其溶液甲的成分,向该溶液甲中加入1mol/L的盐酸,所加入的盐酸与产生CO2的体积(标况)的关系如图所示:
将一定体积的CO2通入到50mL某浓度的NaOH溶液中,得到溶液甲.为了测定其溶液甲的成分,向该溶液甲中加入1mol/L的盐酸,所加入的盐酸与产生CO2的体积(标况)的关系如图所示:(1)写出AB段发生的离子方程式
(2)当加入25mL盐酸时,产生的CO2的体积为
(3)溶液甲中所含的溶质是
(4)原NaOH溶液的物质的量浓度为
考点:有关混合物反应的计算,离子方程式的书写
专题:图示题
分析:(1)AB段生成二氧化碳,反应方程式为:NaHCO3+HCl=NaCl+CO2↑+H2O;
(2)当加入25mL盐酸时,前15mL没有气体生成,有10mL盐酸反应生成二氧化碳,结合方程式计算生成二氧化碳的体积;
(3)若甲中溶质为Na2CO3,则OA段发生:Na2CO3+HCl=NaHCO3+NaCl,而AB段发生反应:NaHCO3+HCl=NaCl+CO2↑+H2O,由方程式可知前后两阶段消耗盐酸体积相等,结合两阶段实际消耗盐酸体积判断;
(4)加入35mL盐酸时,碳酸氢钠恰好完全反应,此时溶液中溶质为NaCl,由钠离子、氯离子守恒可知n(NaOH)=n(NaCl)=n(HCl),进而计算氢氧化钠的浓度.
(2)当加入25mL盐酸时,前15mL没有气体生成,有10mL盐酸反应生成二氧化碳,结合方程式计算生成二氧化碳的体积;
(3)若甲中溶质为Na2CO3,则OA段发生:Na2CO3+HCl=NaHCO3+NaCl,而AB段发生反应:NaHCO3+HCl=NaCl+CO2↑+H2O,由方程式可知前后两阶段消耗盐酸体积相等,结合两阶段实际消耗盐酸体积判断;
(4)加入35mL盐酸时,碳酸氢钠恰好完全反应,此时溶液中溶质为NaCl,由钠离子、氯离子守恒可知n(NaOH)=n(NaCl)=n(HCl),进而计算氢氧化钠的浓度.
解答:
解:(1)AB段生成二氧化碳,反应方程式为:NaHCO3+HCl=NaCl+CO2↑+H2O,反应离子方程为:HCO3-+H+=H2O+CO2↑,
故答案为:HCO3-+H+=H2O+CO2↑;
(2)当加入25mL盐酸时,前15mL没有气体生成,有10mL盐酸反应生成二氧化碳,HCl物质的量为0.01L×1mol/L=0.01mol,由方程式NaHCO3+HCl=NaCl+CO2↑+H2O,可知生成二氧化碳为0.01mol,标况下其体积为0.01mol×22.4L/mol=0.224L,
故答案为:0.224;
(3)若甲中溶质为Na2CO3,则OA段发生:Na2CO3+HCl=NaHCO3+NaCl,而AB段发生反应:NaHCO3+HCl=NaCl+CO2↑+H2O,由方程式可知前后两阶段消耗盐酸体积相等,图象中生成二氧化碳消耗的盐酸体积更多,故甲中溶质为NaHCO3和Na2CO3,
故答案为:NaHCO3和Na2CO3;
(4)加入35mL盐酸时,碳酸氢钠恰好完全反应,此时溶液中溶质为NaCl,由钠离子、氯离子守恒可知n(NaOH)=n(NaCl)=n(HCl)=0.035L×1mol/L=0.035mol,故氢氧化钠的浓度为
=0.7mol/L,
故答案为:0.7.
故答案为:HCO3-+H+=H2O+CO2↑;
(2)当加入25mL盐酸时,前15mL没有气体生成,有10mL盐酸反应生成二氧化碳,HCl物质的量为0.01L×1mol/L=0.01mol,由方程式NaHCO3+HCl=NaCl+CO2↑+H2O,可知生成二氧化碳为0.01mol,标况下其体积为0.01mol×22.4L/mol=0.224L,
故答案为:0.224;
(3)若甲中溶质为Na2CO3,则OA段发生:Na2CO3+HCl=NaHCO3+NaCl,而AB段发生反应:NaHCO3+HCl=NaCl+CO2↑+H2O,由方程式可知前后两阶段消耗盐酸体积相等,图象中生成二氧化碳消耗的盐酸体积更多,故甲中溶质为NaHCO3和Na2CO3,
故答案为:NaHCO3和Na2CO3;
(4)加入35mL盐酸时,碳酸氢钠恰好完全反应,此时溶液中溶质为NaCl,由钠离子、氯离子守恒可知n(NaOH)=n(NaCl)=n(HCl)=0.035L×1mol/L=0.035mol,故氢氧化钠的浓度为
| 0.035mol |
| 0.05L |
故答案为:0.7.
点评:本题考查混合物的有关计算、图象分析处理能力,难度中等,关键根据图中盐酸的体积判断甲溶液中溶质.

练习册系列答案
相关题目
在标准状况下,a g气体A与b g气体B的分子数相同,则正确的是( )
| A、气体A和气体B的摩尔质量之比为b:a |
| B、同温同压下,气体A和气体B的密度之比为b:a |
| C、质量相同的气体A与气体B的分子数之比为a:b |
| D、相同状况下,同体积的气体A与气体B的质量之比为a:b |
2013年2月1日上午9时许,连霍高速义昌大桥上一辆装载烟花炮竹的货车发生爆炸,导致大桥垮塌,造成重大损失.制作烟花炮竹需要硝酸钾,下列关于硝酸钾的叙述不正确的是( )
| A、是一种盐 |
| B、化学式KNO3 |
| C、摩尔质量为101g |
| D、难以发生复分解反应 |
 如图:纵坐标表示可燃气体A、B、C(C是A和B的混合物)的体积,横坐标表示A、B、C在完全燃烧时,消耗O2的体积,测混合气体C中A和B的体积比为( )
如图:纵坐标表示可燃气体A、B、C(C是A和B的混合物)的体积,横坐标表示A、B、C在完全燃烧时,消耗O2的体积,测混合气体C中A和B的体积比为( )| A、VA:VB=1:1 |
| B、VA:VB=1:2 |
| C、VA:VB=2:1 |
| D、VA:VB为任意比 |
用惰性电极电解一定浓度的CuSO4溶液,一段时间后在电解后的溶液中加入0.1mol Cu(OH)2可以恢复到原来的状态,则电解过程中转移的电子的物质的量为( )
| A、0.1mol |
| B、0.2mol |
| C、0.3mol |
| D、0.4mol |
 等质量的两种金属粉末A、B分别与同浓度的足量稀盐酸反应,都生成+2价金属氯化物,其反应情况如图所示:
等质量的两种金属粉末A、B分别与同浓度的足量稀盐酸反应,都生成+2价金属氯化物,其反应情况如图所示: