题目内容
19.高氯酸铜[Cu(ClO4)2•6H2O]易溶于水,120℃开始分解,常用于生产电极和作催化剂等.制备高氯酸铜的流程如下: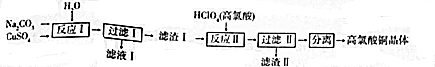
(1)该流程张经过两次过滤操作,实验室过滤操作中需要的玻璃仪器有烧杯、玻璃棒、漏斗;上述流程中“过滤Ⅰ”后需对滤渣进行洗涤,检验滤渣Ⅰ是否洗涤干净的实验方法是取少量最后一次洗涤滤液,向其中加入用盐酸酸化的氯化钡,若无沉淀出现则说明已经洗涤干净,反之,未洗涤干净.
(2)滤渣Ⅰ的主要成分为Cu2(OH)2CO3,上述流程中反应Ⅱ的化学方程式是Cu2(OH)2CO3+4HClO4=2Cu(ClO4)2+CO2↑+3H2O.
(3)加热时,Cu(ClO4)2的分解方式有以下两种:
(A)2Cu(ClO4)2$\frac{\underline{\;\;△\;\;}}{\;}$2CuO+7O2↑+2Cl2↑ (B)Cu(ClO4)2$\frac{\underline{\;\;△\;\;}}{\;}$CuCl2+4O2↑
取一定质量的Cu(ClO4)2•6H2O样品,加热至某温度使其完全分解,若测得V(O2):V(Cl2)=5:1,计算确定分解所得固定产物中CuO的质量分数(写出计算过程,结果保留两位小数).
分析 根据流程图可知,碳酸钠与硫酸铜在水中反应生成Cu2(OH)2CO3,过滤后在Cu2(OH)2CO3中加入高氯酸生成高氯酸铜和二氧化碳,进而得到高氯酸铜晶体,
(1)根据过滤操作确定所需仪器,滤渣Ⅰ的表面可溶性杂质有碳酸根离子,通过检验硫酸根离子的存在判断是否洗涤干净;
(2)Cu2(OH)2CO3中加入高氯酸生成高氯酸铜和二氧化碳,根据元素守恒书写化学方程式;
(3)根据反应(A)2Cu(ClO4)2$\frac{\underline{\;\;△\;\;}}{\;}$2CuO+7O2↑+2Cl2↑、(B)Cu(ClO4)2$\frac{\underline{\;\;△\;\;}}{\;}$CuCl2+4O2↑,由氧气和氯气的关系可确定氧化铜和氯化铜的物质的量的关系,进而可计算出所得固定产物中CuO的质量分数;
解答 解:根据流程图可知,碳酸钠与硫酸铜在水中反应生成Cu2(OH)2CO3,过滤后在Cu2(OH)2CO3中加入高氯酸生成高氯酸铜和二氧化碳,进而得到高氯酸铜晶体,
(1)根据过滤操作所需仪器有烧杯、玻璃棒、漏斗,滤渣Ⅰ的表面可溶性杂质有硫酸根离子,所以判断是否洗涤干净的方法是取少量最后一次洗涤滤液,向其中加入用盐酸酸化的氯化钡,若无沉淀出现则说明已经洗涤干净,反之,未洗涤干净,
故答案为:烧杯、玻璃棒、漏斗;取少量最后一次洗涤滤液,向其中加入用盐酸酸化的氯化钡,若无沉淀出现则说明已经洗涤干净,反之,未洗涤干净;
(2)Cu2(OH)2CO3中加入高氯酸生成高氯酸铜和二氧化碳,反应的化学方程式为Cu2(OH)2CO3+4HClO4=2Cu(ClO4)2+CO2↑+3H2O,
故答案为:Cu2(OH)2CO3+4HClO4=2Cu(ClO4)2+CO2↑+3H2O;
(3)设分解所得固定产物中CuO的物质的量为xmol,CuCl2的物质的量为ymol,根据反应(A)2Cu(ClO4)2$\frac{\underline{\;\;△\;\;}}{\;}$2CuO+7O2↑+2Cl2↑、(B)Cu(ClO4)2$\frac{\underline{\;\;△\;\;}}{\;}$CuCl2+4O2↑,生成氧气的物质的量为(3.5x+4y)mol,氯气的物质的量为xmol,根据题意V(O2):V(Cl2)=(3.5x+4y):x=5:1,所以x:y=8:3,所以所得固定产物中CuO的质量分数为$\frac{80x}{80x+135y}$×100%=$\frac{80}{80+\frac{3}{8}×135}$×100%=61.24%,
故:分解所得固定产物中CuO的质量分数为61.24%.
点评 本题考查了物质制备实验设计步骤和过程分析判断,化学方程式计算应用,物质提纯的实验方法应用,答题时注意流程的分析和实验基本操作的灵活运用,题目难度中等.

 阅读快车系列答案
阅读快车系列答案| A. | X的主要化合价是-2、+4、+6 | |
| B. | 可以形成稳定的气态氢化物 | |
| C. | X的最高价氧化物对应水化物的酸性比HBrO4的酸性强 | |
| D. | X原子的还原性比碘原子强 |
| A. | 钠与水反应:Na+H2O═Na++OH-+H2↑ | |
| B. | 向AlCl3溶液中加入过量的氨水溶液:Al3++3OH-═Al(OH)3↓ | |
| C. | 铁与氯化铁溶液反应:Fe+Fe3+═2Fe2+ | |
| D. | 铝与氢氧化钠溶液反应:2Al+2OH-+2H2O═2AlO2+3H2↑ |
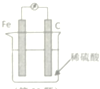
| A. | 在铁棒上产生气泡,碳棒上没有气泡 | |
| B. | H+在溶液中定向流向铁 | |
| C. | 电子由铁电极经导线流向碳棒 | |
| D. | 该装置能将电能转化为化学能 |
| A. | 在镀件上镀铜时,将镀件与电源的负极相连 | |
| B. | 用电解法精炼铜时,用稀硫酸作电解质溶液 | |
| C. | 碱性电池负极由锌片改为锌粉,可大幅提高放电电流 | |
| D. | 实验室用锌与稀硫酸反应制取氢气时,向硫酸溶液中滴加几滴CuSO4溶液,可加快化学反应速率 |
| A. | 单晶硅太阳能电池的光电转换效率为100% | |
| B. | 高溫下碳能将二氧化硅还原为硅,则C的非金属性比Si强 | |
| C. | Mg2Si与盐酸作用制得硅烷的方程式为:Mg2Si+4HCl═2MgCl2+SiH4↑ | |
| D. | 一种硅酸盐云母[KAl2(AlSi3O10)(OH)2用氧化物形式可表示为:K2O•3Al2O3•6SiO2•H2O |
 酚
酚 酯
酯 羧酸
羧酸 氯代烃
氯代烃 醇CH3C≡CH炔.
醇CH3C≡CH炔.