题目内容
20.下列涉及的实验方案或工业方案不能达到目的是( )| A. | 用FeCl3溶液刻制铜材电路板 | |
| B. | 用乙醇作萃取剂从碘水中提取碘 | |
| C. | 在常温下用铝制容器贮运浓硫酸 | |
| D. | 向含硫高的煤中加入生石灰,可减少燃料对大气的污染 |
分析 A.FeCl3溶液刻制铜材电路板生成氯化铜和氯化亚铁;
B.乙醇与水互溶;
C.常温下,浓硫酸和Al发生钝化现象而阻止进一步反应;
D.生石灰和二氧化硫反应生成亚硫酸钙.
解答 解:A.FeCl3溶液刻制铜材电路板生成氯化铜和氯化亚铁,可刻制铜材电路板,故A正确;
B.乙醇与水互溶,不能用作萃取剂,故B错误;
C.常温下,浓硫酸和Al发生氧化还原反应生成一层致密的氧化物 薄膜而阻止进一步被氧化,该现象称为钝化现象,所以可在常温下用铝制容器贮运浓硫酸,故C正确;
D.生石灰和二氧化硫反应生成亚硫酸钙,从而减少二氧化硫的排放,能减少大气污染,故D正确.
故选B.
点评 本题考查较为综合,涉及物质的分离、储存以及环境污染等知识,综合考查学生的分析能力、实验能力和评价能力,为高考常见题型,注意把握物质的性质的异同以及实验的严密性和可行性的评价,难度不大.

练习册系列答案
相关题目
8.下列有关硅及其化合物的说法治确的是( )
| A. | 单晶硅太阳能电池的光电转换效率为100% | |
| B. | 高溫下碳能将二氧化硅还原为硅,则C的非金属性比Si强 | |
| C. | Mg2Si与盐酸作用制得硅烷的方程式为:Mg2Si+4HCl═2MgCl2+SiH4↑ | |
| D. | 一种硅酸盐云母[KAl2(AlSi3O10)(OH)2用氧化物形式可表示为:K2O•3Al2O3•6SiO2•H2O |
15.某课外学习小组为了探究NO参与的硫酸型酸雨的形成,在烧瓶中充入含有少量NO的SO2气体,先慢慢通入O2,一段时间后,再喷射蒸馏水即得硫酸型酸雨.则关于NO的作用说法正确的是( )
| A. | 还原剂 | B. | 氧化剂 | C. | 反应物 | D. | 催化剂 |
5.下列各组物质中,不满足组内任意两种物质在一定条件下均能发生反应的是( )
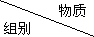 | 甲 | 乙 | 丙 |
| A | NaHCO3 | HCl | Ca(OH)2 |
| B | O2 | SO2 | NaOH |
| C | NH3 | NO2 | H2O |
| D | H2SO4(浓) | Fe | S |
| A. | A | B. | B | C. | C | D. | D |
10.下列有关说法正确的是( )
| A. | 将0.2mol/L的NH3•H2O与0.1mol/L的HCl溶液等体积混合后pH>7,则c(Cl-)>c(NH4+)>c(OH-)>c(H+) | |
| B. | 已知MgCO3的Ksp=6.82×10-6,则所有含有固体MgCO3的溶液中,都有(Mg2+)=c(CO32-),且c(Mg2+)•c(CO32-)=6.82×10-6mol/L | |
| C. | 用惰性电极电解Na2SO4溶液,阳阴两极产物的物质的量之比为2:1 | |
| D. | 0.1mol/LNa2CO3溶液与0.1mol/LNaHCO3溶液等体积混合:$\frac{2}{3}$c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3) |
 酚
酚 酯
酯 羧酸
羧酸 氯代烃
氯代烃 醇CH3C≡CH炔.
醇CH3C≡CH炔.