题目内容
1.向0.1mol/LCH3COOH溶液中加入少量NaOH固体(忽略温度、体积变化),增大的是( )| A. | 氢离子浓度 | B. | 水的电离程度 | C. | 水的离子积 | D. | 醋酸浓度 |
分析 醋酸为弱电解质,与NaOH发生中和反应生成CH3COONa为强电解质,且醋酸钠水解促进水的电离,而醋酸电离显酸性抑制水的电离,有关,水的离子积与温度以此来解答.
解答 解:A.加NaOH发生中和反应,氢离子浓度减小,故A不选;
B.醋酸电离显酸性抑制水的电离,中和反应生成的醋酸钠水解促进水的电离,则水的电离程度增大,故B选;
C.温度不变,水的离子积不变,故C不选;
D.随中和反应的进行,醋酸浓度减小,故D不选;
故选B.
点评 本题考查酸碱混合的定性判断,为高频考点,把握反应中离子浓度的变化、盐类水解及弱酸电离为解答的关键,侧重分析与应用能力的考查,注意水的电离平衡,题目难度不大.

练习册系列答案
 黄冈冠军课课练系列答案
黄冈冠军课课练系列答案
相关题目
9.分子式为C8H10的芳香烃,其可能的结构有( )
| A. | 4种 | B. | 5种 | C. | 6种 | D. | 7种 |
16.下列说法正确的是( )
| A. | 同周期的ⅡA族与ⅢA族元素的原子序数一定相差1 | |
| B. | 镁、铝、铜、铁、钠五种金属元素中,铜和铁属于过渡元素 | |
| C. | 元素的非金属性越强,其气态氢化物水溶液的酸性越强 | |
| D. | 第三周期非金属元素含氧酸的酸性从左到右依次增强 |
6.探究浓度对化学平衡的影响,实验如下:
Ⅰ.向5mL 0.05mol/L FeCl3溶液中加入5mL 0.05mol/L KI溶液(反应a),平衡后分为两等份
Ⅱ.向一份加入饱和KSCN溶液,变红(反应b);加入CCl4,振荡、静置,下层显极浅的紫色
Ⅲ.向另一份加入CCl4,振荡、静置,下层显紫红色
结合实验,下列说法不正确的是( )
Ⅰ.向5mL 0.05mol/L FeCl3溶液中加入5mL 0.05mol/L KI溶液(反应a),平衡后分为两等份
Ⅱ.向一份加入饱和KSCN溶液,变红(反应b);加入CCl4,振荡、静置,下层显极浅的紫色
Ⅲ.向另一份加入CCl4,振荡、静置,下层显紫红色
结合实验,下列说法不正确的是( )
| A. | 反应a为:2Fe3++2I-?2Fe2++I2 | B. | Ⅱ中,反应a进行的程度大于反应b | ||
| C. | 比较氧化性:Ⅱ中,I2>Fe3+ | D. | 比较水溶液中c(Fe2+):Ⅱ<Ⅲ |
13.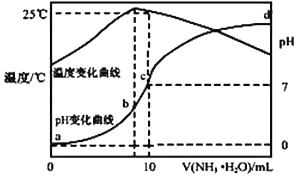 在某温度时,将 n mol•L-1氨水滴入 10mL 1.0mol•L-1 盐酸中,溶液 pH 和温度随加入氨 水体积变化曲线如图所示,下列有关说法正确的是( )
在某温度时,将 n mol•L-1氨水滴入 10mL 1.0mol•L-1 盐酸中,溶液 pH 和温度随加入氨 水体积变化曲线如图所示,下列有关说法正确的是( )
 在某温度时,将 n mol•L-1氨水滴入 10mL 1.0mol•L-1 盐酸中,溶液 pH 和温度随加入氨 水体积变化曲线如图所示,下列有关说法正确的是( )
在某温度时,将 n mol•L-1氨水滴入 10mL 1.0mol•L-1 盐酸中,溶液 pH 和温度随加入氨 水体积变化曲线如图所示,下列有关说法正确的是( )| A. | a 点 Kw=1.0×10-14 | |
| B. | 水的电离程度:b>c>a>d | |
| C. | b 点:c(NH4+)>c(Cl-)>c(H +)>c(OH -) | |
| D. | 25℃时 NH4Cl 水解常数为(10n-1)×10-7mol•L-1(用 n 表示) |
10.如图是某有机物结构的球棍模型,下列有关叙述正确的是( )
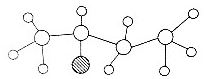

| A. | 该有机物肯定是的含烃氧衍生物 | |
| B. | 该有机物能发生取代反应和加成反应 | |
| C. | 该有机物可能是C4H9Cl | |
| D. | 该有机物可能与CH3CH2OCH2CH2互为同分异构体 |
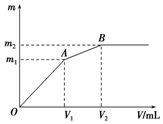 向含0.02mol Al3+的明矾溶液中逐滴加入0.2mol/L的Ba(OH)2溶液时,测得产生沉淀的质量m和逐滴加入Ba(OH)2溶液的体积V的关系如图所示.计算出A、B点分别对应的m、V,填 在下面的横线上.
向含0.02mol Al3+的明矾溶液中逐滴加入0.2mol/L的Ba(OH)2溶液时,测得产生沉淀的质量m和逐滴加入Ba(OH)2溶液的体积V的关系如图所示.计算出A、B点分别对应的m、V,填 在下面的横线上.
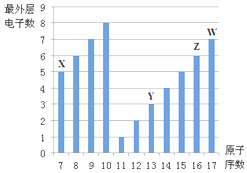 如图是部分短周期元素最外层电子数与原子序数的关系图.
如图是部分短周期元素最外层电子数与原子序数的关系图.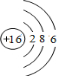 .
.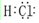 .
.