题目内容
1.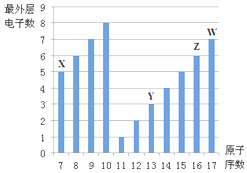 如图是部分短周期元素最外层电子数与原子序数的关系图.
如图是部分短周期元素最外层电子数与原子序数的关系图.请回答下列问题:
(1)画出Z的原子结构示意图
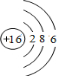 .
.(2)原子半径:Y>Z(填“>”、“<”).
(3)Y的最高价氧化物的水化物与氢氧化钠溶液反应的化学方程式为Al(OH)3+NaOH=NaAlO2+2H2O.
(4)X的最高价氧化物的水化物的化学式为HNO3.
(5)画出W的氢化物的电子式
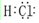 .
.
分析 (1)Z的原子序数为16,是硫元素,氯原子的核电荷数=核外电子总数=16,最外层含有6个电子;
(2)Y、Z的原子序数分别为13、16,二者分别为Al、S元素,结合同一周期中原子序数越大原子半径越小分析;
(3)Y的最高价氧化物对应水合物为氢氧化铝,氢氧化铝为两性氢氧化物,能够与氢氧化钠溶液反应生成偏铝酸钠和水;
(4)X的原子序数为7,为N元素,其最高价含氧酸为硝酸;
(5)W的原子序数为17,是Cl元素,其氢化物氯化氢为共价化合物.
解答 解:(1)Z的原子序数为16,为S元素,其原子结构示意图为: ,故答案为:
,故答案为: ;
;
(2)Y的原子序数为13,为Al元素,Z为S元素,二者位于同一周期,同一周期主族元素的原子序数越大原子半径越小,则原子半径大小为:Al>S
故答案为:>;
(3)Y为Al所以,其最高价氧化物的水化物为氢氧化铝,氢氧化铝与氢氧化钠溶液反应的化学方程式为:Al(OH)3+NaOH=NaAlO2+2H2O,
故答案为:Al(OH)3+NaOH=NaAlO2+2H2O;
(4)X的原子序数为7,是N元素,其最高价氧化物的水化物为硝酸,硝酸的化学式为:HNO3,
故答案为:HNO3;
(5)W的原子序数=17,为Cl元素,其氢化物为HCl,HCl为共价化合物,分子中含有1个H-Cl键,其电子式为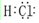 ,
,
故答案为: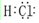 .
.
点评 本题考查了位置、结构与性质关系的应用,题目难度中等,明确原子结构与元素周期表、元素周期律的关系为解答关键,试题有利于提高学生的分析能力及灵活应用能力.

练习册系列答案
 全能测控期末小状元系列答案
全能测控期末小状元系列答案
相关题目
1.向0.1mol/LCH3COOH溶液中加入少量NaOH固体(忽略温度、体积变化),增大的是( )
| A. | 氢离子浓度 | B. | 水的电离程度 | C. | 水的离子积 | D. | 醋酸浓度 |
9.下列有机物的命名正确的是( )
| A. | 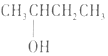 2--羟基丁烷 2--羟基丁烷 | B. | 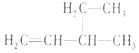 3--乙基--1--丁烯 3--乙基--1--丁烯 | ||
| C. | 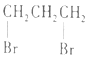 1,3--二溴丙烷 1,3--二溴丙烷 | D. | 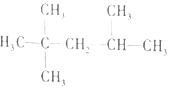 2,2,3--三甲基戊烷 2,2,3--三甲基戊烷 |
6.化学与人类杜会生产、生活密切相关,下列说法正确的是( )
| A. | DNOP(邻苯二甲酸二辛脂)是一种由邻苯二甲酸和正辛醇经脂化反应而得的一种酯类有机化合物,常用作增塑剂、溶剂以及气相色谱固定液,对人体无害,可用作食品添加剂 | |
| B. | 铝及其合金是电气、工业、家底广泛使用的材料,是因为铝的冶炼方法比较简单 | |
| C. | 陶瓷、砖瓦、玻璃、水泥都是硅酸盐产品 | |
| D. | 白酒标签上注有“酒精度52%Vol”字样,它表示100g该白酒中含有52g洒精 |
13.Na2O2、Cl2和SO2均能使品红溶液褪色,下列说法正确的是( )
| A. | Na2O2和CO2反应中,Na2O2既是氧化剂又是还原剂 | |
| B. | Na2O2、Cl2、SO2使品红溶液褪色的原理相同 | |
| C. | 等物质的量的Cl2和SO2同时通入品红溶液中,品红褪色更快 | |
| D. | 在Na2O2中阴阳离子所含的电子数目相等 |
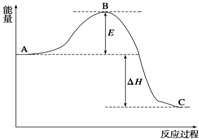 2SO2(g)+O2(g)?2SO3(g),反应过程的能量变化如图
2SO2(g)+O2(g)?2SO3(g),反应过程的能量变化如图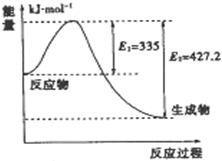 到目前为止,由化学能转变的热能或电能仍然是人类使用的最主要的能源.
到目前为止,由化学能转变的热能或电能仍然是人类使用的最主要的能源.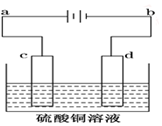 电解装置如图所示:
电解装置如图所示: