题目内容
19.在一定温度下,10L密闭容器中加入5molSO2、4molO2,经10min后反应达平衡时有3molSO2发生了反应.试计算:(1)用SO2表示该反应的反应速率为多少0.03mol/(L.min).
(2)平衡时O2的转化率为37.5%.
(3)平衡时O2在反应混合气中的物质的量分数33.3%.
(4)平衡常数K值为9.
分析 经10min后反应达平衡时有3molSO2发生了反应,则
2SO2+O2?2SO3,
开始 5 4 0
转化 3 1.5 3
平衡 2 2.5 3
(1)结合v=$\frac{△c}{△t}$计算;
(2)转化率=$\frac{转化的量}{开始的量}$×100%;
(3)平衡时O2在反应混合气中的物质的量分数为$\frac{2.5}{2+2.5+3}$;
(4)K为生成物浓度幂之积与反应物浓度幂之积的比.
解答 解:经10min后反应达平衡时有3molSO2发生了反应,则
2SO2+O2?2SO3,
开始 5 4 0
转化 3 1.5 3
平衡 2 2.5 3
(1)用SO2表示该反应的反应速率为$\frac{\frac{3mol}{10L}}{10min}$=0.03mol/(L.min),故答案为:0.03mol/(L.min);
(2)平衡时O2的转化率为$\frac{1.5mol}{4mol}$×100%=37.5%,故答案为:37.5%;
(3)平衡时O2在反应混合气中的物质的量分数为$\frac{2.5}{2+2.5+3}$×100%=33.3%,故答案为:33.3%;
(4)平衡常数K=$\frac{0.{3}^{2}}{0.{2}^{2}×0.25}$=9,故答案为:9.
点评 本题考查化学平衡的计算,为高频考点,把握化学平衡三段法、转化率及K的计算为解答的关键,侧重分析与计算能力的考查,注意利用平衡浓度计算K,题目难度不大.

练习册系列答案
 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案
相关题目
9. 25℃时,部分物质的电离常数如表所示:
25℃时,部分物质的电离常数如表所示:
请回答下列问题:
(1)同浓度的a.CH3COO-,b.HCO3-,c.CO32-,d.ClO-结合H+的能力由强到弱的顺序为c>d>b>a(填编号).
(2)向NaClO溶液中通入少量的CO2,反应的离子方程式为ClO-+CO2+H2O=HCO3-+HClO.
(3)pH相同的下列四种物质的溶液:a.Na2CO3,b.NaClO,c.CH3COONa,d.NaHCO3,物质的量浓度由大到小的顺序是b>a>d>c(填编号).
(4)常温下0.1mol•L-1的CH3COOH溶液在加水稀释过程中,下列表达式的数据一定变小的是A(填序号).
A.c(H+) B.$\frac{c({H}^{+})}{c(C{H}_{3}COOH)}$
C.c(H+)•c(OH-) D. c(H+)•$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$
若该溶液升高温度,上述5种表达式的数据增大的是ABCD.
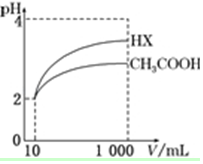
(5)体积为10mL pH=2的醋酸溶液与一元酸HX分别加水稀释至1 000mL,稀释过程中pH变化如图所示,则HX的电离常数大于(填“大于”、“等于”或“小于”)醋酸的电离常数;稀释后,HX溶液中由水电离出来的c(H+)大于(填“大于”、“等于”或“小于”)醋酸溶液中由水电离出来的c(H+).
 25℃时,部分物质的电离常数如表所示:
25℃时,部分物质的电离常数如表所示:| 化学式 | CH3COOH | H2CO3 | HClO |
| 电离常数 | 1.7×10-5 | K1=4.3×10-7 K2=5.6×10-11 | 3.0×10-8 |
(1)同浓度的a.CH3COO-,b.HCO3-,c.CO32-,d.ClO-结合H+的能力由强到弱的顺序为c>d>b>a(填编号).
(2)向NaClO溶液中通入少量的CO2,反应的离子方程式为ClO-+CO2+H2O=HCO3-+HClO.
(3)pH相同的下列四种物质的溶液:a.Na2CO3,b.NaClO,c.CH3COONa,d.NaHCO3,物质的量浓度由大到小的顺序是b>a>d>c(填编号).
(4)常温下0.1mol•L-1的CH3COOH溶液在加水稀释过程中,下列表达式的数据一定变小的是A(填序号).
A.c(H+) B.$\frac{c({H}^{+})}{c(C{H}_{3}COOH)}$
C.c(H+)•c(OH-) D. c(H+)•$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$
若该溶液升高温度,上述5种表达式的数据增大的是ABCD.
(5)体积为10mL pH=2的醋酸溶液与一元酸HX分别加水稀释至1 000mL,稀释过程中pH变化如图所示,则HX的电离常数大于(填“大于”、“等于”或“小于”)醋酸的电离常数;稀释后,HX溶液中由水电离出来的c(H+)大于(填“大于”、“等于”或“小于”)醋酸溶液中由水电离出来的c(H+).
10.按照物质的树状分类和交叉分类,HNO3应属于( )
①强酸 ②氧化物 ③含氧酸 ④一元酸 ⑤电解质 ⑥混合物 ⑦无机化合物.
①强酸 ②氧化物 ③含氧酸 ④一元酸 ⑤电解质 ⑥混合物 ⑦无机化合物.
| A. | ①③④⑤⑦ | B. | ①②③④⑤⑦ | C. | ①②③④⑥ | D. | ①④⑥⑦ |
7.一定温度下,水存在H2O?H++OH-△H=Q(Q>0)的平衡,下列叙述一定正确的是( )
| A. | 向水中滴入少量稀盐酸,平衡逆向移动,Kw 减小 | |
| B. | 将水加热,Kw增大,pH<7 | |
| C. | 向水中通入少量HCl气体,平衡逆向移动,c(H+ )降低 | |
| D. | 向水中加入少量固体硫酸钠,c(H+ )和Kw 均不变 |
14.已知:H2(g)+F2(g)═2HF(g)△H=-270kJ•mol-1,下列说法正确的是( )
| A. | 2 L氟化氢气体分解成1 L氢气与1 L氟气吸收270 kJ热量 | |
| B. | 在相同条件下,1 mol氢气与1 mol氟气的能量总和大于2 mol氟化氢气体的能量 | |
| C. | 1 mol氢气与1 mol氟气反应生成2 mol液态氟化氢放出的热量小于270 kJ | |
| D. | 1个氢气分子与1个氟气分子反应生成2个氟化氢气体分子放出270 kJ热量 |
4.下列关于热化学描述正确的是( )
| A. | HCl和NaOH反应的中和热△H=-57.3 kJ•mol-1,则H2SO4和Ca(OH)2反应的中和热△H=2×(-57.3)kJ•mol-1 | |
| B. | CO(g)燃烧热283.0 kJ•mol-1,2CO2(g)═2CO(g)+O2(g)的△H=+2×283.0 kJ•mol-1 | |
| C. | 需要加热才能发生的反应一定是吸热反应 | |
| D. | 1 mol甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷的燃烧热 |
11.下列各项操作错误的是( )
| A. | 萃取、分液前需对分液漏斗检漏 | |
| B. | 进行分液时,分液漏斗中的下层液体从下端流出,上层液体则从上口倒出 | |
| C. | 为保证分液漏斗内的液体顺利流出,需将分液漏斗上面的塞子打开 | |
| D. | 用酒精萃取溴水中的溴单质的操作可选用分液漏斗,而后静置分液 |