题目内容
14.已知:H2(g)+F2(g)═2HF(g)△H=-270kJ•mol-1,下列说法正确的是( )| A. | 2 L氟化氢气体分解成1 L氢气与1 L氟气吸收270 kJ热量 | |
| B. | 在相同条件下,1 mol氢气与1 mol氟气的能量总和大于2 mol氟化氢气体的能量 | |
| C. | 1 mol氢气与1 mol氟气反应生成2 mol液态氟化氢放出的热量小于270 kJ | |
| D. | 1个氢气分子与1个氟气分子反应生成2个氟化氢气体分子放出270 kJ热量 |
分析 热化学反应方程式中化学计量数只表示物质的量,且该反应为放热反应,则反应物的总能量大于生成物的总能量,以此来解答.
解答 解:热化学反应方程式中化学计量数只表示物质的量,则A、D错误;
B.为放热反应,则1 mol氢气与1 mol氟气的能量总和大于2 mol氟化氢气体的能量,故B正确;
C.HF由气态变为液态放热,则1 mol氢气与1 mol氟气反应生成2 mol液态氟化氢放出的热量大于270 kJ,故C错误;
故选B.
点评 本题考查反应热与焓变,为高频考点,把握反应中能量变化、物质状态及化学计量数与能量的关系为解答的关键,侧重分析与应用能力的考查,注意选项C为易错点,题目难度不大.

练习册系列答案
相关题目
4.下列说法正确的是( )
| A. | 25℃、101kPa时,1mol物质完全燃烧时所放出的热量,叫做该物质的燃烧热 | |
| B. | 化石燃料在任何条件下都能充分燃烧 | |
| C. | 燃烧热或中和热是反应热的种类之一 | |
| D. | 弱酸和碱发生中和反应生成1mol水,这时的反应热叫中和热 |
5.下列叙述正确的是( )
| A. | 直径介于1nm~100nm之间的微粒称为胶体 | |
| B. | 电泳现象可以证明胶体粒子带电 | |
| C. | 丁达尔效应是溶液与胶体的本质区别 | |
| D. | 胶体粒子很小,可以透过滤纸和半透膜 |
2.下列物质的分离方法不正确的是( )
| A. | 用蒸馏的方法将自来水制成蒸馏水 | B. | 用过滤的方法除去食盐水中的泥沙 | ||
| C. | 用淘洗的方法从沙里淘金 | D. | 用酒精萃取碘水中的碘 |
9.在2L的恒容容器中,充入1molA和3molB,并在一定条件下发生如下反应:A(g)+3B(g)?2C(g);经3s后达到平衡,测得C气体的浓度为0.6mol•L-1,下列说法中不正确的是( )
| A. | 用A表示反应的速率为0.1 mol•L-1•s-1 | |
| B. | 用B表示反应速率为0.4 mol•L-1•s-1 | |
| C. | 3s时生成C的物质的量为1.2mol | |
| D. | 3s时B的浓度为0.6mol•L-1 |
6.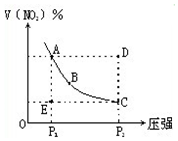 对于反应N2O4?2NO2在温度一定时,平衡体系中NO2的体积分数V(NO2)%随压强的变化情况如图所示(实线上的任何一点为对应压强下的平衡点).下列说法正确的是( )
对于反应N2O4?2NO2在温度一定时,平衡体系中NO2的体积分数V(NO2)%随压强的变化情况如图所示(实线上的任何一点为对应压强下的平衡点).下列说法正确的是( )
 对于反应N2O4?2NO2在温度一定时,平衡体系中NO2的体积分数V(NO2)%随压强的变化情况如图所示(实线上的任何一点为对应压强下的平衡点).下列说法正确的是( )
对于反应N2O4?2NO2在温度一定时,平衡体系中NO2的体积分数V(NO2)%随压强的变化情况如图所示(实线上的任何一点为对应压强下的平衡点).下列说法正确的是( )| A. | A、C两点的正反应速率的关系A>C | |
| B. | A、B、C、D、E各状态,V正>V逆的是状态D | |
| C. | 使E状态从水平方向到达C状态,从理论上来讲,可选用的条件是从P1突然加压至P2 | |
| D. | 维持P1不变,E→A所需时间为x,维持P2不变,D→C所需时间为y,则x<y |
3.下列关于物质分类的说法,正确的是( )
| A. | 碱性氧化物一定是金属氧化物,金属氧化物一定是碱性氧化物 | |
| B. | 由一种元素组成的物质一定是单质,两种元素组成的物质一定是化合物 | |
| C. | 非金属氧化物不一定是酸性氧化物,酸性氧化物不一定都是非金属氧化物 | |
| D. | 硫酸、纯碱、石膏是按酸、碱、盐排列的 |