题目内容
6.相同温度下等物质的量浓度的下列溶液中,c(NH4+)最大的是( )| A. | CH3COONH4 | B. | NH3•H2O | C. | NH4Cl | D. | NH4HSO4 |
分析 设选项中溶质均为1mol/L,则A中相互促进水解,D在氢离子抑制铵根离子水解,B中电离程度很小,以此来解答.
解答 解:设选项中溶质均为1mol/L,则A中相互促进水解,D在氢离子抑制铵根离子水解,B中电离程度很小,则c(NH4+)为D>C>A>B,即c(NH4+)最大的为D,最接近1mol/L,故选D.
点评 本题考查离子浓度比较及盐类水解,为高频考点,把握水解与电离为解答的关键,侧重分析与应用能力的考查,注意水解平衡抑制及电离程度,题目难度不大.

练习册系列答案
相关题目
16.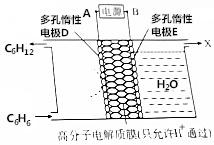 利用电化学原理,使苯(C6H6)转化为环己烷(C6H12)可实现电化学储氢和储能;反应装置如图所示,下列判断错误的是( )
利用电化学原理,使苯(C6H6)转化为环己烷(C6H12)可实现电化学储氢和储能;反应装置如图所示,下列判断错误的是( )
 利用电化学原理,使苯(C6H6)转化为环己烷(C6H12)可实现电化学储氢和储能;反应装置如图所示,下列判断错误的是( )
利用电化学原理,使苯(C6H6)转化为环己烷(C6H12)可实现电化学储氢和储能;反应装置如图所示,下列判断错误的是( )| A. | A极为电源的正极 | |
| B. | 储氢反应的电极反应式为:C6H6+6H++6e-═C6H12 | |
| C. | 右室得到的气体X为O2 | |
| D. | 该储氢和储能的反应为2C6H6+6H2O$\frac{\underline{\;通电\;}}{\;}$2C6H12+3O2↑ |
17.一定量的混合气体在密闭容器中发生反应:mA(g)+nB(g)?pC(g)达到平衡时,维持温度不变,将气体体积缩小到原来的$\frac{1}{2}$,当达到新的平衡时,气体C的浓度变为原平衡时的1.9倍,则下列说法正确的是( )
| A. | m+n>p | B. | m+n<p | ||
| C. | 平衡向正反应方向移动 | D. | C的质量分数增加 |
14.设NA为阿伏加德罗常数的值,下列说法正确的是( )
| A. | 64gCaC2中含有的共价键数目为3NA | |
| B. | 20gD2O与20gH218O含有的中子数均为11NA | |
| C. | 4.6gNO2在标准状况下,含有的分子数为0.1 NA | |
| D. | 50ml 12mol/L盐酸与足量MnO2共热,转移的电子数为0.3NA |
1.某有机物键线式的结构为  ,关于其说法正确的是( )
,关于其说法正确的是( )
 ,关于其说法正确的是( )
,关于其说法正确的是( )| A. | 分子式为C8H10O2 | |
| B. | 可发生氧化、取代、加成反应 | |
| C. | 该有机物的含酯基的芳香族化合物的同分异构体有4种 | |
| D. | 它的另一种同分异构体 最多有13个原子共平面 最多有13个原子共平面 |
11.在密闭容器中,一定条件下进行如下反应:NO(g)+CO(g)?$\frac{1}{2}$N2(g)+CO2(g)△H=-373.2KJ/mol,达到平衡后,为提高NO的转化率,可采取的措施是( )
| A. | 加催化剂 | B. | 扩大容器体积 | C. | 升高温度 | D. | 增大压强 |
18.在下列各组溶液中,离子一定能大量共存的是( )
| A. | 加入KSCN溶液显红色的溶液:K+、NH4+、Cl-、I- | |
| B. | NaHCO3溶液中:Na+、K+、SO42-、AlO2- | |
| C. | $\frac{{K}_{W}}{c({H}^{+})}$=0.1 mol•L-1的溶液:Na+、K+、SiO32-、NO3- | |
| D. | 水电离出的c(H+)=1×10-13mol/L的溶液:Na+、K+、AlO2-、CO32- |
15.下列有关实验叙述及操作正确的是( )
| A. |  观察Fe(OH)2的生成 | |
| B. | 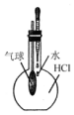 用图所示方法验证HCl气体易溶于水 | |
| C. | 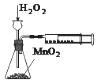 用图定量测定H2O2的分解速率 | |
| D. | 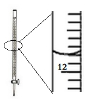 记录滴定终点读数为12.20mL |
10.在碱性溶液中能大量共存且为无色透明的溶液是( )
| A. | K、Cl-、MnO4-、SO42- | B. | Na+、SO42-、NO3-、CO32- | ||
| C. | Na+、NO3-、SO42-、HCO3- | D. | Ca2+、SO42-、S2-、Cl- |