题目内容
12. NO2是形成雾霾天气的原因之一.
NO2是形成雾霾天气的原因之一.(1)重型车辆常在排气管内喷淋尿素[CO(NH2)2]溶液,使NO2转化为无污染物质.采用“喷淋”的目的是增大接触面积,加快反应速率,反应的活化能不变(选填“增大”“减小”“不变”),写出该反应的化学方程式:6NO2+4CO(NH2)2=7N2+4CO2+8H2O.【已知:CO(NH2)2中N呈-3价】
(2)以CO2与NH3为原料可合成化肥尿素.已知:
①2NH3(g)+CO2(g)=NH2CO2NH4(s)△H=-l59.5kJ•mol-1
②NH2CO2NH4(s)=CO(NH2)2(s)+H2O(l)△H=-160.5kJ•mol-1
③H2O(l)=H2O(g)△H=+44.0kJ•mol-1
写出CO2与NH3合成尿素和气态水的热化学反应方程式2NH3(g)+CO2(g)=CO(NH2)2(s)+H2O(g)△H=-276.0kJ•mol-1.
(3)恒温下将1.6mol NH3和0.8mol CO2放入容积为8L的恒容密闭容器中,反应生成NH2CO2NH4(s),下列各项能说明反应达到平衡状态的是ac.
a.容器内气体压强保持不变b.CO2与NH3的速率之比为1:2
c.NH2CO2NH4(s)质量保持不变d.容器内温度保持不变
该反应达到平衡时,测得CO2的物质的量浓度为0.05mol•L-1.则平衡时CO2的转化率α=50%;若其他条件不变,移去少量NH2CO2NH4,CO2的转化率不变(选填“增大”“减小”“不变”).
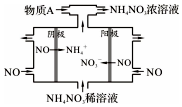
(4)为减少NO2排放,可将NO2转化为NO后通入如图所示装置,同时补充气体物质A使NO全部转化为NH4NO3,该装置中总化学反应方程式是8NO+2NH3+7H2O=5NH4NO3.
分析 (1)在排气管内将尿素溶液采用喷淋的形式与NO2作用,可结合影响反应速率的因素考虑,活化能是化学反应本身的性质,与影响反应的条件无关;尿素与NO2反应生成无污染的物质,产物应该是CO2、N2和水,结合原子守恒和电子守恒配平可得此反应的化学方程式;
(2)依据热化学方程式和盖斯定律计算①+②+③得到CO2与NH3合成尿素和气态水的热化学反应方程式;
(3)判断可逆反应2NH3(g)+CO2(g)?CO(NH2)2(s)+H2O(g),是否达到平衡状态,可结合平衡状态的特征v(正)=v(逆)≠0,反应体系各物质的量不再随时间变化而变化来判断;
转化率=$\frac{消耗量}{起始量}$×100%,可结合“三行式”计算CO2的转化率;平衡体系中改变固体反应物或生成物的量不影响反应速率,不影响平衡的移动;
(4)电解NO制备 NH4NO3,由装置图可知阳极发生氧化反应,NO被氧化生成NO3-,阴极发生还原反应,NO被还原生成NH4+,阳极反应为NO-3e-+2H2O=NO3-+4H+,阴极反应为:NO+5e-+6H+=NH4++H2O,结合电极方程式解答该题.
解答 解:(1)尿素以喷淋的形式进入排气管,可增大与NO2气体的接触面积,加快了反应速率,但不改变反应的活化能;尿素与NO2反应生成CO2、N2和水的化学方程式是6NO2+4CO(NH2)2=7N2+4CO2+8H2O,
故答案为:增大接触面积,加快反应速率;不变;6NO2+4CO(NH2)2=7N2+4CO2+8H2O;
(2)①2NH3(g)+CO2(g)=NH2CO2NH4(s)△H=-l59.5kJ•mol-1
②NH2CO2NH4(s)=CO(NH2)2(s)+H2O(l)△H=-160.5kJ•mol-1
③H2O(l)=H2O(g)△H=+44.0kJ•mol-1
依据热化学方程式和盖斯定律计算①+②+③得到CO2与NH3合成尿素和气态水的热化学反应方程式为2NH3(g)+CO2(g)=CO(NH2)2(s)+H2O(g)△H=-276.0KJ/mol;
故答案为:2NH3(g)+CO2(g)=CO(NH2)2(s)+H2O(g)△H=-276.0 KJ/mol;
(3)a.反应前后气体反应物和生成物的系数和不等,正反应是体积减小的方向,在恒温恒容条件下,压强不变是平衡状态,故a正确;b.伴随反应的进行,CO2与NH3的速率之比始终为1:2,无法判断是平衡状态,故b错误;c.NH2CO2NH4(s)质量保持不变可说明是平衡状态,故c正确;d.反应在恒温条件下进行,无法判断是平衡状态,故d错误;
2NH3+CO2?NH2CO2NH4,
起始量(mol/L)0.2 0.1 0
变化量(mol/L)0.1 0.05 0
平衡量(mol/L) 0.1 0.05 0
CO2的转化率=$\frac{消耗量}{起始量}$×100%=$\frac{0.05mol/L}{0.1mol/L}$×100%=50%,
改变NH2CO2NH4(s)质量平衡不移动,CO2的转化率不变;
故答案为:ac;50%;不变;
(4)电解NO制备NH4NO3,阳极反应为NO-3e-+2H2O=NO3-+4H+,阴极反应为:NO+5e-+6H+=NH4++H2O,从两极反应可看出,要使得失电子守恒,阳极产生的NO3-的物质的量大于阴极产生的NH4+的物质的量,总电极反应方程式为:8NO+7H2O$\frac{\underline{\;通电\;}}{\;}$3NH4NO3+2HNO3,可知补充的A为NH3,使NO全部转化为NH4NO3总化学反应方程式是8NO+2NH3+7H2O=5NH4NO3;
故答案为:8NO+2NH3+7H2O=5NH4NO3.
点评 本题考查盖斯定律的应用、平衡状态的判断、化学反应速率的影响因素、转化率的计算及电解原理的应用等,题目难度中等,侧重于考查学生对基础知识的综合应用能力.

 名校课堂系列答案
名校课堂系列答案| A. | 加入少量盐酸观察是否有气体产生 | |
| B. | 加热观察是否有气体产生 | |
| C. | 加入过量盐酸观察是否有气体产生 | |
| D. | 加入少量碳酸氢钙溶液观察是否有沉淀产生 |
| A. | Cu(OH)2溶于醋酸:Cu(OH)2+2H+═Cu2++2H2O | |
| B. | AgNO3溶液中加入过量的氨水:Ag++NH3•H2O═AgOH↓+NH4+ | |
| C. | AgCl悬浊液中加入Na2S溶液:2AgCl+S2-═Ag2S+2Cl- | |
| D. | 明矾溶液中加入过量Ba(OH)2溶液:2Al3++3SO42-+3Ba2++4OH-═2AlO2-+3BaSO4↓+2H2O |
| A. | m+n>p | B. | m+n<p | ||
| C. | 平衡向正反应方向移动 | D. | C的质量分数增加 |
| A. | 相同温度下,AgCl的溶解性比Ag2CO3强 | |
| B. | 沉淀转化反应2AgCl(s)+CO32-(aq)?Ag2CO3(s)+2Cl-(aq)的平衡常数为20mol•L-1 | |
| C. | 混合后溶液中的:c(Na+)>c (Cl-)>c (CO32-)>c (OH-)>c(H+) | |
| D. | 混合后溶液中的:c(Na+)+c(H+)+c(Ag+)=2 c(CO32-)+c(HCO3-)+c(OH-) |
 ,关于其说法正确的是( )
,关于其说法正确的是( )| A. | 分子式为C8H10O2 | |
| B. | 可发生氧化、取代、加成反应 | |
| C. | 该有机物的含酯基的芳香族化合物的同分异构体有4种 | |
| D. | 它的另一种同分异构体 最多有13个原子共平面 最多有13个原子共平面 |
| A. | Na2O2与H2O反应 | B. | 灼热的木炭与水蒸气反应 | ||
| C. | 铝热反应 | D. | CH4与O2反应 |
 如图所示,A处通气体,B处加热一段时间后,停止加热,观察现象:
如图所示,A处通气体,B处加热一段时间后,停止加热,观察现象: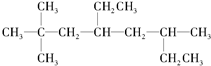 的系统名称是2,2,6-三甲基-4-乙基辛烷,其一氯代物有10种.
的系统名称是2,2,6-三甲基-4-乙基辛烷,其一氯代物有10种. 在催化剂存在下完全氢化,所得烷烃的系统名称是2-甲基丁烷.
在催化剂存在下完全氢化,所得烷烃的系统名称是2-甲基丁烷. 的分子式为C4H8O;
的分子式为C4H8O; 名称为:1,2-二甲基苯(或邻二甲苯).
名称为:1,2-二甲基苯(或邻二甲苯).