题目内容
15. 工业制硫酸尾气中的SO2,是一种空气污染物,同时也是一种重要的化工原料,采用氨吸收法进行循环利用,便可以变废为宝.
工业制硫酸尾气中的SO2,是一种空气污染物,同时也是一种重要的化工原料,采用氨吸收法进行循环利用,便可以变废为宝.(1)用氨水吸收尾气中的SO2可生成亚硫酸铵,发生反应的化学方程式为2NH3•H2O+SO2=(NH4)2SO3+H2O
(2)随着SO2的吸收,吸收液中的NH4HSO3浓度达到一定程度后,再向其中加入稀硫酸,放出SO2循环使用,同时生成另一种副产物(NH4)2SO4(填化学式)可用作化肥.
(3)在城市的污水的处理中,SO2可用于处理排放前的氯化污水,则氯化污水中的氯气与SO2反应的化学方程式为SO2+Cl2+2H2O=H2SO4+2HCl
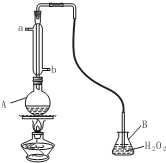
(4)二氧化硫通常作为保护剂添加到葡萄酒中,有杀菌、抗氧化、澄 清、溶解、改善风味和增酸的作用,但吸人过量的二氧化硫对人 体有害.我国国家标准规定葡萄酒中SO2的最大使用量为0.25g•L-l.右图为某兴趣小组对葡萄酒中的SO2进行收集与测量的装置.
①冷凝管中水的进口为:b(填“a”或“b”)
②A中加入300.00ml葡萄酒和适量盐酸,加热使SO2全部逸出并与B中H2O2完全反应,其化学方程式为
SO2+H2O2=H2SO4
③除去B中过量的H2O2,然后用0.0900mol/L NaOH标准溶液进行滴定,滴定至终点时,消耗NaOH溶液25.00ml,该葡萄酒中SO2含量为:0.24g/L.
分析 (1)氨气、二氧化硫和水反应生成亚硫酸铵,结合原子守恒配平书写化学方程式;
(2)尾气中的SO2用氨吸收,先用氨水吸收尾气中的SO2,反应生成亚硫酸铵或亚硫酸氢铵,亚硫酸铵或亚硫酸氢铵与硫酸反应生成硫酸铵、二氧化硫和水;
(3)氯气、水、SO2反应生成硫酸和盐酸;
(4)①为了充分冷却气体,应该下口进水;
②二氧化硫具有还原性,能够与过氧化氢反应生成硫酸,据此写出反应的化学方程式;
③根据关系式2NaOH~H2SO4~SO2及氢氧化钠的物质的量计算出二氧化硫的质量,再计算出该葡萄酒中的二氧化硫含量.
解答 解:(1)氨气、二氧化硫和水反生成亚硫酸铵,结合原子守恒配平书写化学方程式为:2NH3•H2O+SO2=(NH4)2SO3+H2O,
故答案为:2NH3•H2O+SO2=(NH4)2SO3+H2O;
(2)尾气中的SO2用氨吸收,先用氨水吸收尾气中的SO2,化学方程式为:SO2+2NH3+H2O=(NH4)2SO3,(NH4)2SO3+SO2+H2O=2NH4HSO3;当吸收液中NH4HSO3达到一定浓度后,再与硫酸反应,放出的SO2可循环利用,生成的(NH4)2SO4可作化肥,化学方程式是:2NH4HSO3+H2SO4=(NH4)2SO4+2SO2↑+2H2O,(NH4)2SO3+H2SO4=(NH4)2SO4+SO2↑+H2O,
故答案为:(NH4)2SO4;
(3)SO2可用于处理排放前的氯化污水,则氯化污水中的氯气与SO2反应的化学方程式为:Cl2+SO2+2H2O=H2SO4+2HCl,
故答案为:Cl2+SO2+2H2O=H2SO4+2HCl;
(4)①根据仪器A的构造可知,仪器A为冷凝管,冷凝管中通水方向采用逆向通水法,冷凝效果最佳,所以应该进水口为b,
故答案为:b;
②双氧水具有氧化性,能够将二氧化硫氧化成硫酸,反应的化学方程式为:SO2+H2O2=H2SO4,
故答案为:SO2+H2O2=H2SO4;
③根据2NaOH~H2SO4~SO2可知SO2的质量为:$\frac{1}{2}$×(0.0900mol/L×0.025L)×64g/mol=0.072g,该葡萄酒中的二氧化硫含量为:$\frac{0.72g}{0.3L}$=0.24g/L,
故答案为:0.24.
点评 本题考查了探究物质的组成、测量物质的含量的方法,题目难度中等,试题涉及了二氧化硫性质、中和滴定的计算,要求学生掌握探究物质组成、测量物质含量的方法,明确二氧化硫的化学性质及中和滴定的操作方法及计算方法,试题培养了学生灵活应用所学知识的能力

 阳光课堂同步练习系列答案
阳光课堂同步练习系列答案| A. | CH2=CH-Cl | B. | CH≡CH | C. |  | D. | CH2=c(CH3)-CH=CH2 |
| A. | 钠投入水中:Na+2H2O═Na++2OH-+H2↑ | |
| B. | 用小苏打治疗胃酸过多:CO32-+2H+=CO2↑+H2 | |
| C. | 用FeCl3溶液腐蚀印刷电路板:Fe3++Cu═Fe2++Cu2+ | |
| D. | KI溶液与H2SO4酸化的H2O2溶液混合:2I-+H2O2+2H+═2H2O+I2 |
| A. | 在pH=3的溶液中,Na+、Cl-、Fe2+、ClO-可以大量共存 | |
| B. | pH=11的NaOH溶液与pH=3的醋酸溶液等体积混合,滴入石蕊溶液呈红色 | |
| C. | 常温下,pH=7的NH4Cl与氨水的混合溶液中:c(Cl-)>c(NH4+)>c(H+)=c(OH-) | |
| D. | 向0.1mol•L-1的氨水中加入少量硫酸铵固体,则溶液中c(OH-)/c(NH3•H2O)增大 |
| A. | C2H4和C2H6O2 | B. | C4H6和C3H8 | C. | C5H10O和C3H6O | D. | C3H6和C3H8O |
| 元素编号 | 元素性质或原子结构 |
| T | M层电子数是K层的三倍 |
| X | 最高化合价为+7价 |
| Y | 短周期主族元素原子中半径最大 |
| Z | 地壳中含量最多的金属元素 |
A、冷浓硝酸 B、热浓硫酸 C、浓盐酸 D、稀硝酸
(2)可用于扑灭Y单质燃烧引起的火灾的物质是C.
A、二氧化碳 B、水 C、沙土 D、干粉(主要成分为NaHCO3)
(3)元素X与元素T相比,非金属性较弱的是S(用元素符号表示).下列表述中能证明这一事实的是B.
A、在溶液中T的单质能置换出X的单质;
B、X的气态氢化物比T的气态氢化物更稳定
(4)四种元素的最高价氧化物中Z的最高价氧化物的化学特性是两性.