题目内容
1.已知:①2H2(g)+O2(g)=2H2O(l)△H=-571.6kJ/mol②H+(aq)+OH-(aq)=H2O(l)△H=-57.3kJ/mol
下列说法中错误的是( )
| A. | ①式表示常温常压时,2 mol H2和1 mol O2完全燃烧生成2 mol H2O(l)放热571.6 kJ | |
| B. | 2H2(g)+O2(g)=2H2O(g)中△H大于-571.6 kJ•mol-1 | |
| C. | 将含1 mol NaOH的水溶液与50 g 98%的硫酸溶液混合后放出的热量大于57.3 kJ | |
| D. | 将含1 mol NaOH的稀溶液与含1 mol CH3COOH的稀溶液混合后放出的热量为57.3 kJ |
分析 A、根据热化学方程式的含义分析;
B、根据液态水汽化需吸收要能量来判断;
C、酸碱恰好反应生成1mol水,但浓硫酸混合后溶解放热;
D、醋酸是弱电解质存在电离平衡,电离过程是吸热过程.
解答 解:A、①2H2(g)+O2(g)=2H2O(l)△H=-571.6kJ•mol-1,表示25℃,101 kpa时,2 mol H2和1 mol O2完全燃烧生成2 mol H2O(l)放热571.6 kJ,焓变与变化过程无关,故A正确;
B、2H2(g)+O2(g)=2H2O(l)△H=-571.6kJ•mol-1,2H2O(l)=2H2O(g)△H>0;所以两个方程式相加得到:2H2(g)+O2(g)=2H2O(g),△H大于-571.6 kJ•mol-1,故B正确;
C、将含1 mol NaOH的水溶液与50 g 98%的硫酸溶液混合后,浓硫酸溶解放热,放出的热量大于57.3 kJ,故C错误;
D、将含1 mol NaOH的稀溶液与含1 mol CH3COOH的稀溶液混合后,醋酸电离是吸热过程,所以反应放出的热量小于57.3 kJ,故D正确;
故选C.
点评 本题考查了热化学方程式的含义和书写,盖斯定律的应用,理解溶解热和电离过程中的能量改变是解题的关键.

练习册系列答案
 黎明文化寒假作业系列答案
黎明文化寒假作业系列答案
相关题目
11.据科学家预测,月球的土壤中吸附着数百万吨的${\;}_{2}^{3}$He,每百吨${\;}_{2}^{3}$He核聚变所释放的能量相当于目前人类一年消耗的能量.在地球上,氦元素主要以${\;}_{2}^{4}$He的形式存在.下列说法正确的是( )
| A. | ${\;}_{2}^{4}$He原子核内含有4个质子 | |
| B. | ${\;}_{2}^{3}$He和${\;}_{2}^{4}$He互为同位素 | |
| C. | ${\;}_{2}^{3}$He原子核内含有3个中子 | |
| D. | ${\;}_{2}^{4}$He最外层电子数为2,具有较强金属性 |
9.下列说法正确的是( )
| A. | CO2晶体和SiO2晶体中,微粒之间的化学键类型相同,晶体类型也相同 | |
| B. | H2S分子中,所有原子的最外层都达到了8电子的稳定结构 | |
| C. | 碘单质升华过程中不存在化学键被破坏的过程 | |
| D. | NaCl气体溶于水后,因为共价键被破坏,从而形成了Na+和Cl- |
16.下列物质属于纯净物的是( )
| A. | 福尔马林 | B. | 聚乙烯 | C. | 纤维素 | D. | 硬脂酸甘油酯 |
13.下列化合物中,既含有离子键又含有共价键的是( )
| A. | NaNO3 | B. | MgO | C. | C2H6 | D. | CO2 |
10.下列说法中,正确的是( )
| A. | 任何化学反应都伴随着能量的变化 | |
| B. | H2O(气)-→H2O(液)该过程放出大量的热,所以该过程是化学变化 | |
| C. | 化学反应中能量的变化都表现为热量的变化 | |
| D. | 所有的物质一定存在化学键 |


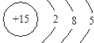 、其最高价氧化物对应的水化物的化学式H3PO4.
、其最高价氧化物对应的水化物的化学式H3PO4.