题目内容
2.BF3与一定量的水形成晶体Q[(H2O)2•BF3],Q在一定条件下可转化为R:
晶体Q中各种微粒间的作用力不涉及( )
①离子键 ②共价键 ③配位键 ④金属键 ⑤氢键 ⑥范德华力.
| A. | ①⑤ | B. | ②⑥ | C. | ①④ | D. | ①④⑥ |
分析 非金属元素原子之间易形成共价键,含有空轨道的原子和含有孤电子对的原子之间易形成配位键,分子之间存在范德华力,水分子中的O原子和其它分子中的H原子易形成氢键,以此来解答.
解答 解:Q非金属元素原子之间易形成共价键,B原子含有空轨道、O原子含有孤电子对,所以B原子和O原子之间存在配位键,分子之间存在范德华力,水分子中的O原子和其它分子中的H原子易形成氢键,所以不涉及的是离子键和金属键,
故选C.
点评 本题考查化学键及晶体类型,为高频考点,把握化学键的形成及判断的一般规律为解答的关键,侧重分析与应用能力的考查,配位键为解答的难点,题目难度不大.

练习册系列答案
相关题目
13.下列化合物中,既含有离子键又含有共价键的是( )
| A. | NaNO3 | B. | MgO | C. | C2H6 | D. | CO2 |
10.下列说法中,正确的是( )
| A. | 任何化学反应都伴随着能量的变化 | |
| B. | H2O(气)-→H2O(液)该过程放出大量的热,所以该过程是化学变化 | |
| C. | 化学反应中能量的变化都表现为热量的变化 | |
| D. | 所有的物质一定存在化学键 |
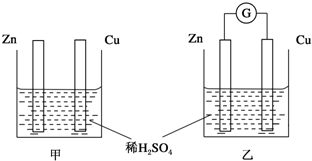
17.某同学在用稀硫酸与锌制取氢气的实验中,发现反应条件不同,反应速率不同.请回答下列问题:
(1)在用稀硫酸与锌制取氢气的实验中,加入少量硫酸铜溶液可加快氢气的生成速率.
①加入硫酸铜溶液后可以加快氢气生成速率的原因是CuSO4与Zn反应产生的Cu与Zn形成Cu-Zn原电池,加快了氢气生成的速率.
②实验室中现有Na2SO4、MgSO4、Ag2SO4、K2SO4等4种溶液,可与上述实验中CuSO4溶液起相似作用的是Ag2SO4.
③为了进一步研究硫酸铜的量对氢气生成速率的影响,该同学设计了如下一系列的实验:将表中所给的混合溶液分别加入到6个盛有过量Zn粒的容器中,收集产生的气体,记录获得相同体积的气体所需时间.
请完成此实验设计,其中:V1=30,V6=10.
该同学最后得出的结论为:当加入少量CuSO4溶液时,生成氢气的速率会大大提高,但当加入的CuSO4溶液超过一定量时,生成氢气的速率反而会下降.请分析氢气生成速率下降的主要原因当加入一定量的硫酸铜后,生成的单质铜会沉积在锌的表面,降低了锌与溶液的接触面积.
(2)该同学为探究其它因素对锌与稀硫酸反应速率的影响,又做了以下实验,记录数据如下,回答下列问题:
①由实验可推知,反应物的总能量>产物的总能量(填“<”“>”“=”).
②实验2和5表明,浓度 对反应速率有影响.
③实验4和5表明,固体表面积对反应速率有影响,固体表面积越大反应速率越快,能表明同一规律的实验还有1和2(填实验序号).
④本实验中影响反应速率的其他因素还有温度.
(1)在用稀硫酸与锌制取氢气的实验中,加入少量硫酸铜溶液可加快氢气的生成速率.
①加入硫酸铜溶液后可以加快氢气生成速率的原因是CuSO4与Zn反应产生的Cu与Zn形成Cu-Zn原电池,加快了氢气生成的速率.
②实验室中现有Na2SO4、MgSO4、Ag2SO4、K2SO4等4种溶液,可与上述实验中CuSO4溶液起相似作用的是Ag2SO4.
③为了进一步研究硫酸铜的量对氢气生成速率的影响,该同学设计了如下一系列的实验:将表中所给的混合溶液分别加入到6个盛有过量Zn粒的容器中,收集产生的气体,记录获得相同体积的气体所需时间.
实验 混合溶液 | A | B | C | D | E | F |
| 4mol/L H2SO4(mL) | 30 | V1 | V2 | V3 | V4 | V5 |
| 饱和CuSO4溶液(mL) | 0 | 0.5 | 2.5 | 5 | V6 | 20 |
| H2O(mL) | V7 | V8 | V9 | V10 | 10 | 0 |
该同学最后得出的结论为:当加入少量CuSO4溶液时,生成氢气的速率会大大提高,但当加入的CuSO4溶液超过一定量时,生成氢气的速率反而会下降.请分析氢气生成速率下降的主要原因当加入一定量的硫酸铜后,生成的单质铜会沉积在锌的表面,降低了锌与溶液的接触面积.
(2)该同学为探究其它因素对锌与稀硫酸反应速率的影响,又做了以下实验,记录数据如下,回答下列问题:
| 实验序号 | 金属质量/g | 金属状态 | C(H2SO4)/mol.-L | V(H2SO4)/mL | 溶液温度 | 金属消失的时间/s | |
| 反应前 | 反应后 | ||||||
| 1 | 0.1 | 丝 | 0.5 | 50 | 20 | 34 | 500 |
| 2 | 0.1 | 粉末 | 0.5 | 50 | 20 | 35 | 50 |
| 3 | 0.1 | 丝 | 0.7 | 50 | 20 | 36 | 250 |
| 4 | 0.1 | 丝 | 0.8 | 50 | 20 | 35 | 200 |
| 5 | 0.1 | 粉末 | 0.8 | 50 | 20 | 36 | 25 |
| 6 | 0.1 | 丝 | 1.0 | 50 | 20 | 35 | 125 |
| 7 | 0.1 | 丝 | 1.0 | 50 | 35 | 50 | 50 |
②实验2和5表明,浓度 对反应速率有影响.
③实验4和5表明,固体表面积对反应速率有影响,固体表面积越大反应速率越快,能表明同一规律的实验还有1和2(填实验序号).
④本实验中影响反应速率的其他因素还有温度.
14.下列说法不正确的是( )
| A. | 1 mol葡萄糖能水解生成2 mol CH3CH2OH和2 mol CO2 | |
| B. | 医药中常用酒精来消毒,是因为酒精能够使病毒的蛋白质发生变性 | |
| C. | 醋酸和硬脂酸互为同系物,C2H6和C9H20也一定互为同系物 | |
| D. | 丙氨酸和苯丙氨酸脱水缩合,最多可生成4种二肽 |
11.己知1L 0.1mol/L的NaRO3溶液中含RO3-的质量为8.5g.在RO3-中,氧原子中质子数和中子数相等,R的中子数为20,则RO3-的核外电子总数为( )
| A. | 41 | B. | 42 | C. | 44 | D. | 46 |
12.下列有关实验原理、方法和结论都正确的是( )
| A. | 向饱和FeCl3溶液中滴加过量氨水,可制取Fe(OH)3胶体 | |
| B. | 取少量溶液X,向其中加入适量新制的氯水,再加几滴KSCN溶液,溶液变红,说明X溶液中一定含有Fe2+ | |
| C. | 用渗析法除去淀粉中混有的NaCl | |
| D. | 已知${I}_{3}^{-}$?I2+I-,向盛有KI3溶液的试管中加入适量CCl4,振荡静置后CCl4层显紫色,说明KI3在CCl4中的溶解度比在水中的大 |