题目内容
2.设NA为阿伏伽德罗常数的值,下列有关叙述正确的是( )| A. | 标准状况下,22.4LHF中含有的分子数为NA | |
| B. | 常温常压下,硝酸与铜反应得到NO2、N2O4共23g,则铜失去的电子数为0.5NA | |
| C. | 标准状况下,8.96L平均相对分子质量为3.5的H2与D2含有的中子数为0.3NA | |
| D. | 0.1L18mol/L浓硫酸与足量金属铜在加热条件下充分反应,生成0.9NA个SO2分子 |
分析 A、标况下HF为液体;
B、NO2、N2O4的最简式均为NO2,求出23gNO2、N2O4混合物中含有的NO2的物质的量,然后根据由硝酸反应生成NO2时氮元素的化合价由+5价变为+4价来分析;
C、H2与D2的相对分子质量分别为2和4,根据十字交叉法求出两者的比例;
D、铜只能与浓硫酸反应,和稀硫酸不反应.
解答 解:A、标况下HF为液体,故不能根据气体摩尔体积来计算其物质的量,故A错误;
B、NO2、N2O4的最简式均为NO2,23gNO2、N2O4混合物中含有的NO2的物质的量为0.5mol,而由硝酸反应生成NO2时氮元素的化合价由+5价变为+4价,故生成0.5molNO2时,硝酸得0.5mol电子,即铜失去0.5mol电子即0.5NA个,故B正确;
C、H2与D2的相对分子质量分别为2和4,根据十字交叉法可知H2与D2的物质的量之比为1:3,故8.96L即0.4mol的混合气体中H2的物质的量为0.1mol,而D2的物质的量为0.3mol,而H2中不含中子,D2中含2个中子,故0.3molD2中含0.6mol中子即0.6NA个,故C错误;
D、铜只能与浓硫酸反应,和稀硫酸不反应,故硫酸变稀后反应停止,即浓硫酸不能反应完全,则生成的二氧化硫分子个数小于0.9NA个,故D错误.
故选B.
点评 本题考查了阿伏伽德罗常数的有关计算,难度不大,应注意掌握公式的运用和物质的结构.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
12.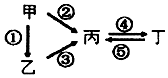 甲、乙、丙、丁均为中学化学常见的纯净物,它们之间有如图所示的反应关系.下列物质组不满足上述转化关系的是( )
甲、乙、丙、丁均为中学化学常见的纯净物,它们之间有如图所示的反应关系.下列物质组不满足上述转化关系的是( )
 甲、乙、丙、丁均为中学化学常见的纯净物,它们之间有如图所示的反应关系.下列物质组不满足上述转化关系的是( )
甲、乙、丙、丁均为中学化学常见的纯净物,它们之间有如图所示的反应关系.下列物质组不满足上述转化关系的是( )| 选项 | 甲 | 乙 | 丙 | 丁 |
| A | Al | Al2O3 | NaAlO2 | Al(OH)3 |
| B | S | H2S | SO3 | H2SO4 |
| C | N2 | NH3 | NO | NO2 |
| D | Si | SiO2 | Na2SiO3 | Na2CO3 |
| A. | A | B. | B | C. | C | D. | D |
13.一个化学电池的总反应方程式为:Zn+2H+═Zn2++H2↑,该化学电池的组成可能为( )
| A | B | C | D | |
| 正极 | 碳棒 | Cu | Zn | Mg |
| 负极 | Zn | Zn | Cu | Zn |
| 电解质溶液 | H2SO4 | CuSO4 | NaCl | HCl |
| A. | A | B. | B | C. | C | D. | D |
10.如图是制备和研究乙炔性质的实验装置图,有关说法不正确的是( )


| A. | 用蒸馏水替代a中饱和食盐水产生的乙炔更为纯净 | |
| B. | c(过量)的作用是除去影响后续实验的杂质 | |
| C. | d、e中溶液褪色的原理不同 | |
| D. | f处产生明亮、伴有浓烟的火焰 |
17.A、B两种有机物组成的混合物,当混合物总质量一定时,无论A、B以何种比例混合,完全燃烧后,生成CO2的质量为定值,则符合这一条件的有机物组合是( )
| A. | 甲醇(CH3OH)和乙二醇(HOCH2CH2OH) | B. | 甲醛(HCHO)和乙醛 (CH3CHO) | ||
| C. | CH4和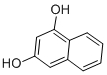 | D. | 苯(C6H6)和苯酚(C6H5OH) |
7.将一定量的铜粉加入到100mL某浓度的稀硝酸中,充分反应后,容器中剩有m1g铜粉,此时共收集到NO气体a mL(标准状况).然后向上述混合物中加入足量稀硫酸至不再反应为止,容器中仍剩有铜粉m2g,则(m1-m2)为( )
| A. | $\frac{9a}{700}$ | B. | $\frac{3a}{700}$ | ||
| C. | 0 | D. | 缺少条件,无法计算 |
14.下列分子中,空间构型为v型的是( )
| A. | NH3 | B. | CCl4 | C. | H2O | D. | CH2O |
11.下列各基态原子或离子的电子排布式错误的是( )
| A. | Al 1s22s22p63s23p1 | B. | S2- 1s22s22p63s23p6 | ||
| C. | Cu[Ar]3d94s2 | D. | Ca[Ar]4s2 |
12.将一定量的CuS投入足量的HNO3中,收集到标准状况下的气体VL向反应后的溶液中加人足量的NaOH,产生蓝色沉淀,经过滤、洗涤、灼烧,得到CuO16g,若上述气体为NO和NO2的混合物,且体积比为1:1,则V为( )
| A. | 9.0L | B. | 13.44L | C. | 17.92L | D. | 16.8L |