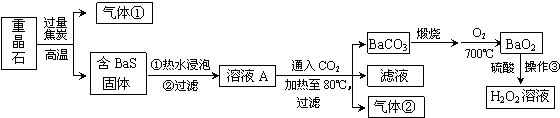
题目内容
7.将一定量的铜粉加入到100mL某浓度的稀硝酸中,充分反应后,容器中剩有m1g铜粉,此时共收集到NO气体a mL(标准状况).然后向上述混合物中加入足量稀硫酸至不再反应为止,容器中仍剩有铜粉m2g,则(m1-m2)为( )| A. | $\frac{9a}{700}$ | B. | $\frac{3a}{700}$ | ||
| C. | 0 | D. | 缺少条件,无法计算 |
分析 铜粉加入到100mL某浓度的稀硝酸中,充分反应后,容器中剩有m1g铜粉,生成Cu(NO3)2和NO气体,根据电子转移守恒计算参加反应的铜的物质的量,再根据铜元素守恒计算溶液中n[Cu(NO3)2],再向溶液中足量稀硫酸至不再反应为止,容器剩有铜粉m2g,Cu(NO3)2中NO3-发生反应3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O,(m1-m2)为与溶液中NO3-反应的铜的质量.
解答 解:铜粉加入到100mL某浓度的稀硝酸中,充分反应后,容器中剩有m1g铜粉,生成Cu(NO3)2和NO气体,NO的物质的量为$\frac{a×10{\;}^{-3}L}{22.4L/mol}$=$\frac{a}{22400}$mol,根据电子转移守恒可知,参加反应的铜的物质的量为$\frac{\frac{a}{22400}×(5-2)}{2}$=$\frac{3a}{44800}$mol,根据铜元素守恒可知,溶液中n[Cu(NO3)2]=$\frac{3a}{44800}$mol,溶液中n(NO3-)=$\frac{3a}{44800}$mol×2=$\frac{3a}{22400}$mol.再向溶液中足量稀硫酸至不再反应为止,Cu(NO3)2中NO3-发生反应3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O,容器剩有铜粉m2g,(m1-m2)为与溶液中NO3-反应的铜的质量,令再次反应的铜的物质的量为xmol,则:
3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O
3 2
xmol $\frac{3a}{22400}$mol
所以x=$\frac{9a}{44800}$mol
所以再次反应的铜的质量为$\frac{9a}{44800}$mol×64g/mol=$\frac{9a}{700}$g,即(m1-m2)=$\frac{9a}{700}$g.
故选:A.
点评 本题考查氧化还原反应的计算,难度中等,判断(m1-m2)为反应后溶液中与NO3-反应的铜的质量,注意根据电子转移守恒、元素守恒计算,如根据方程式计算,相对比较麻烦.

| A. | 镁和铁 | B. | 钠和铁 | C. | 锌和铜 | D. | 铁和铜 |
| A. | NH3分子结构式: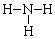 | B. | 氚原子符号:21H | ||
| C. | Mg2+离子的电子式:Mg: | D. | C2H4分子比例模型: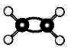 |
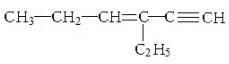 ,下列说法不正确的是( )
,下列说法不正确的是( )| A. | 1mol该烃完全燃烧消耗11mol O2 | |
| B. | 与氢气完全加成后的产物中含3个甲基 | |
| C. | 1mol该烃完全加成消耗Br2的物质的量为3mol | |
| D. | 该烃的核磁共振氢谱有12个峰 |
| A. | 标准状况下,22.4LHF中含有的分子数为NA | |
| B. | 常温常压下,硝酸与铜反应得到NO2、N2O4共23g,则铜失去的电子数为0.5NA | |
| C. | 标准状况下,8.96L平均相对分子质量为3.5的H2与D2含有的中子数为0.3NA | |
| D. | 0.1L18mol/L浓硫酸与足量金属铜在加热条件下充分反应,生成0.9NA个SO2分子 |
| A. | 前者多 | B. | 后者多 | C. | 一样多 | D. | 无法确定 |
| A. | 反应物的总能量低于生成物的总能量时,发生放热反应 | |
| B. | HCl和NaOH反应的中和热△H=-57.3KJ/mol,则H2SO4和Ba(OH)2的反应热△H=2×(-57.3)KJ/mol | |
| C. | 同温同压下,H2(g)+Cl2(g)═2HCl(g)在光照和点燃条件下的△H相同 | |
| D. | 等量的硫蒸气和硫固体分别完全燃烧,后者放出热量多 |