题目内容
13.一个化学电池的总反应方程式为:Zn+2H+═Zn2++H2↑,该化学电池的组成可能为( )| A | B | C | D | |
| 正极 | 碳棒 | Cu | Zn | Mg |
| 负极 | Zn | Zn | Cu | Zn |
| 电解质溶液 | H2SO4 | CuSO4 | NaCl | HCl |
| A. | A | B. | B | C. | C | D. | D |
分析 由电池反应Zn+2H+═Zn2++H2↑可知Zn为负极,正极为比Zn不活泼的金属或惰性电极,电解质溶液为酸溶液,以此来解答.
解答 解:由电池反应Zn+2H+═Zn2++H2↑可知Zn为负极,排除选项C,
正极为比Zn不活泼的金属或惰性电极,Mg比Zn活泼,排除选项D,
电解质溶液为酸溶液,CuSO4溶液不符合,排除选项B,
只有选项A符合,
故选A.
点评 本题考查原电池的设计,明确电池反应及电极材料的选择、电解质溶液的选择即可解答,注重基础知识的考查,题目难度不大.

练习册系列答案
相关题目
3.将容积为40mL的量筒充满二氧化氮和氧气的混合气体,将量筒倒置在盛满水的水槽里,一段时间后,量筒里剩余气体体积为5mL.则原混合气体中NO2和O2体积比可能是( )
| A. | 3:7 | B. | 7:1 | C. | 5:3 | D. | 1:1 |
4.a、b、c、d、e是原子序数依次增大的五种短周期主族元素.b、c、e最外层电子数之和为10;a原子核外最外层电子数是次外层的2倍;c是同周期中原子半径最大的元素;工业上一般通过电解氧化物的方法制备d的单质;e的单质是制备太阳能电池的重要材料.下列说法正确的是( )
| A. | a能将e从其氧化物中置换出来,因此非金属性a>e | |
| B. | b元素的气态氢化物易液化,是因为其分子间能形成氢键 | |
| C. | 工业上不用电解氯化物的方法制备单质d是由于其氯化物的熔点高 | |
| D. | 相同质量的c和d单质分别与足量稀盐酸反应,前者生成的氢气多 |
1.2012年2月新华网报道,加拿大开发出生产医用放射性同位素${\;}_{43}^{99}$Tc的简单方法.下列关于${\;}_{43}^{99}$Tc的叙述正确的是( )
| A. | 原子序数是99 | B. | 质量数是43 | C. | 质子数是56 | D. | 中子数是56 |
8.同分异构体具有相同的:①最简式 ②分子式 ③相对分子质量 ④化学性质 ⑤物理性质( )
| A. | ①②③ | B. | ②⑤ | C. | ②④⑤ | D. | ②③④ |
18.下列化学用语或模型表示正确的是( )
| A. | NH3分子结构式: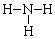 | B. | 氚原子符号:21H | ||
| C. | Mg2+离子的电子式:Mg: | D. | C2H4分子比例模型: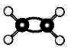 |
5.a、b、c为短周期元素,在周期表中所处位置如表所示.a、c两元素的原子核外电子数之和等于b原子的质子数.b原子核内质子数和中子数相等.则下列说法正确的是( )
| a | c | |
| b |
| A. | a的气态氢化物的水溶液呈酸性 | B. | c的气态氢化物的稳定性最强 | ||
| C. | b的氧化物的水化物是强酸 | D. | 三种元素的原子半径c最大 |
2.设NA为阿伏伽德罗常数的值,下列有关叙述正确的是( )
| A. | 标准状况下,22.4LHF中含有的分子数为NA | |
| B. | 常温常压下,硝酸与铜反应得到NO2、N2O4共23g,则铜失去的电子数为0.5NA | |
| C. | 标准状况下,8.96L平均相对分子质量为3.5的H2与D2含有的中子数为0.3NA | |
| D. | 0.1L18mol/L浓硫酸与足量金属铜在加热条件下充分反应,生成0.9NA个SO2分子 |
3.下列实验中,操作和现象均正确且能实现相应实验目的是( )
| 选项 | 实验目的 | 操作 | 现象 |
| A | 验证BaSO3难溶于水 | 将SO2通入Ba(NO3)2溶液中 | 有白色沉淀生成 |
| B | 验证非金属性:Br>I | 将溴水滴加到淀粉KI溶液中 | 溶液变蓝 |
| C | 验证SO2的漂白性 | 将SO2通入氯水中 | 氯水褪色 |
| D | 验证某化合物是钠盐 | 将该化合物在酒精灯上灼烧 | 焰色为黄色 |
| A. | A | B. | B | C. | C | D. | D |