题目内容
10.如图是制备和研究乙炔性质的实验装置图,有关说法不正确的是( )
| A. | 用蒸馏水替代a中饱和食盐水产生的乙炔更为纯净 | |
| B. | c(过量)的作用是除去影响后续实验的杂质 | |
| C. | d、e中溶液褪色的原理不同 | |
| D. | f处产生明亮、伴有浓烟的火焰 |
分析 由制备和研究乙炔性质的实验装置图可知,b中饱和食盐水与电石发生CaC2+2H2O→Ca(OH)2+C2H2↑,c中硫酸铜除去杂质硫化氢,d中溴水与乙炔发生加成反应,e中乙炔与高锰酸钾发生氧化反应,最后点燃尾气,以此来解答.
解答 解:A.b中饱和食盐水与电石发生CaC2+2H2O→Ca(OH)2+C2H2↑,为制备乙炔的反应原理,蒸馏水代替氯化钠溶液会使反应速率加快,不容易控制,故A错误;
B.c中硫酸铜除去杂质硫化氢,防止硫化氢对后续实验的影响,故B正确;
C.d中溴水与乙炔发生加成反应生成的有机产物为1,1,2,2-四溴乙烷,e中乙炔与高锰酸钾发生氧化反应,高锰酸钾溶液褪色可说明乙炔能被氧化,反应原理不同,故C正确;
D.c中已经排除杂质的干扰,e中乙炔与高锰酸钾发生氧化反应,高锰酸钾溶液褪色可说明乙炔能被氧化,f处若剩余气体应为乙炔,燃烧放出明亮火焰,冒黑烟,故D正确;
故选A.
点评 本题考查物质的制备及性质实验的设计,为高频考点,把握实验装置的作用、反应原理为解答的关键,侧重分析与实验能力的考查,题目难度不大.

练习册系列答案
相关题目
1.2012年2月新华网报道,加拿大开发出生产医用放射性同位素${\;}_{43}^{99}$Tc的简单方法.下列关于${\;}_{43}^{99}$Tc的叙述正确的是( )
| A. | 原子序数是99 | B. | 质量数是43 | C. | 质子数是56 | D. | 中子数是56 |
18.下列化学用语或模型表示正确的是( )
| A. | NH3分子结构式: | B. | 氚原子符号:21H | ||
| C. | Mg2+离子的电子式:Mg: | D. | C2H4分子比例模型: |
5.a、b、c为短周期元素,在周期表中所处位置如表所示.a、c两元素的原子核外电子数之和等于b原子的质子数.b原子核内质子数和中子数相等.则下列说法正确的是( )
| a | c | |
| b |
| A. | a的气态氢化物的水溶液呈酸性 | B. | c的气态氢化物的稳定性最强 | ||
| C. | b的氧化物的水化物是强酸 | D. | 三种元素的原子半径c最大 |
15.某烃的结构简式为: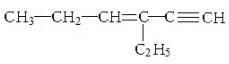 ,下列说法不正确的是( )
,下列说法不正确的是( )
 ,下列说法不正确的是( )
,下列说法不正确的是( )| A. | 1mol该烃完全燃烧消耗11mol O2 | |
| B. | 与氢气完全加成后的产物中含3个甲基 | |
| C. | 1mol该烃完全加成消耗Br2的物质的量为3mol | |
| D. | 该烃的核磁共振氢谱有12个峰 |
2.设NA为阿伏伽德罗常数的值,下列有关叙述正确的是( )
| A. | 标准状况下,22.4LHF中含有的分子数为NA | |
| B. | 常温常压下,硝酸与铜反应得到NO2、N2O4共23g,则铜失去的电子数为0.5NA | |
| C. | 标准状况下,8.96L平均相对分子质量为3.5的H2与D2含有的中子数为0.3NA | |
| D. | 0.1L18mol/L浓硫酸与足量金属铜在加热条件下充分反应,生成0.9NA个SO2分子 |
19.元素的种数与原子的种数相比( )
| A. | 前者多 | B. | 后者多 | C. | 一样多 | D. | 无法确定 |
20.用NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A. | 常温常压下,lmoI丙烷共用电子对数为10 NA | |
| B. | 0.5 moI甲烷和0.5 mol乙酸完全燃烧消耗的O2分子数都为0.2NA | |
| C. | 标准状况下,1L辛烷充分燃烧后生成气态产物的分子数为$\frac{8}{22.4}$NA | |
| D. | 1 mol甲醇与足量钠反应,转移电子数目为2 NA |
 NaCl
NaCl .
.