题目内容
18.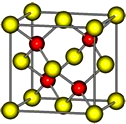 有A、B、C、D、E五种前四周期的元素.A原子核外有1个未成对电子,A+比B原子少一个电子层,B原子得一个电子填入3p轨道后,3p轨道呈全充满状态.C原子的2p轨道有2个未成对电子,D的最高化合价和最低化合价的代数和为4,与C的核电荷数相差8.E位于周期表第12纵列且是六种元素中原子序数最大的.R是由D、E形成的化合物,其晶胞结构如图所示.请回答下列问题:
有A、B、C、D、E五种前四周期的元素.A原子核外有1个未成对电子,A+比B原子少一个电子层,B原子得一个电子填入3p轨道后,3p轨道呈全充满状态.C原子的2p轨道有2个未成对电子,D的最高化合价和最低化合价的代数和为4,与C的核电荷数相差8.E位于周期表第12纵列且是六种元素中原子序数最大的.R是由D、E形成的化合物,其晶胞结构如图所示.请回答下列问题:(1)C元素的电负性>D元素的电负性(填“>”、“<”或“=”).
(2)C的第一电离能比它同周期前一族相邻元素的第一电离能小(填“大”或“小”).
(3)E的价电子排布式为3d104s2,该元素位于周期表中ⅡB族.
(4)化合物A2D的电子式为
 .
.(5)D和B形成的一种化合物D2B2广泛用于橡胶工业,它的分子结构与双氧水相似,但在该化合物分子中,所有原子最外层均满足8电子稳定结构.则D2B2分子中D原子的杂化类型是sp3,D2B2是极性分子(填“极性”或“非极性”).
(6)R的化学式为ZnS(用元素符号表示).已知R晶体的密度为ρ g•cm-3,则该晶胞的边长a=$\root{3}{\frac{388}{ρ{N}_{A}}}$ cm,(阿伏加德罗常数用NA表示).
分析 A、B、C、D、E五种前四周期的元素,
B原子得一个电子填入3p轨道后,3p轨道呈全充满状态,则B是Cl元素;
A原子核外有1个未成对电子,A+比B原子少一个电子层,则A为Na元素;
C原子的2p轨道有2个未成对电子,D的最高化合价和最低化合价的代数和为4,与C的原子序数相差8,则C和D属于同一主族元素,C为O元素、D为S元素;
E位于周期表第12纵行且是六种元素中原子序数最大的,则E是Zn元素,R是由D、E形成的化合物,其晶胞结构如图所示,该晶胞中红色小球个数是4,黄色小球个数=8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,所以其化学式为ZnS,再结合物质结构、元素周期表分析解答.
解答 解:A、B、C、D、E五种前四周期的元素,
B原子得一个电子填入3p轨道后,3p轨道呈全充满状态,则B是Cl元素;
A原子核外有1个未成对电子,A+比B原子少一个电子层,则A为Na元素;
C原子的2p轨道有2个未成对电子,D的最高化合价和最低化合价的代数和为4,与C的原子序数相差8,则C和D属于同一主族元素,C为O元素、D为S元素;
E位于周期表第12纵行且是六种元素中原子序数最大的,则E是Zn元素,R是由D、E形成的化合物,其晶胞结构如图所示,该晶胞中红色小球个数是4,黄色小球个数=8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,所以其化学式为ZnS,
(1)C为O元素、D为S元素,O元素的电负性较大,故答案为:>;
(2)同一周期元素第一电离能随着原子序数增大而呈增大趋势,但第IIA族、第VA族元素第一电离能大于其相邻元素,C为O元素位于第VIA族,所以C的第一电离能比它同周期前一族相邻元素的第一电离能小,
故答案为:小;
(3)E是Zn元素,位于周期表第四周期ⅡB族,价层电子排布为3d104s2,故答案为:3d104s2;ⅡB;
(4)化合物A2D为Na2S,为离子化合物,电子式为 ,故答案为:
,故答案为: ;
;
(5)S2Cl2分子中,所有原子最外层均满足8电子稳定结构,则该分子结构式为Cl-S-S-Cl,根据其结构式知,每个M原子价层电子对个数都是4,则M原子采用sp3杂化,S2Cl2是展开书页型结构,Cl-S位于两个书页面内,该物质结构不对称,正负电荷重心不重合,为极性分子,故答案为:sp3;极性;
(6)如果以上分析知,R的化学式为ZnS,该物质是由阴阳离子构成的,属于离子晶体;
该晶胞属于面心立方结构,晶胞的边长=$\root{3}{\frac{m}{ρ}}$cm=$\root{3}{\frac{\frac{4×(65+32)}{{N}_{A}}}{ρ}}$cm=$\root{3}{\frac{388}{ρ{N}_{A}}}$cm,
故答案为:ZnS;$\root{3}{\frac{388}{ρ{N}_{A}}}$.
点评 本题考查了物质结构和性质,涉及晶胞计算、元素周期律、核外电子排布、原子杂化方式判断等知识点,根据晶胞计算公式、元素周期律内涵、构造原理、价层电子对互斥理论分析解答即可,难点是晶胞计算,注意(5)中S2Cl2分子极性判断,为易错点.

| 反应物 | 溴水 | 酸性KMnO4溶液 | 氢硫酸(H2S溶液) | 滴有酚酞的NaOH溶液 | 石蕊试液 | 品红溶液 |
| 反应现象 | ||||||
| SO2的性质 |
| A. | 原子半径的大小顺序为:rX>rY>rZ>rW>rQ | |
| B. | Z和Q形成的化合物为离子化合物 | |
| C. | 不存在由元素Z与元素W形成的化合物的水溶液 | |
| D. | 元素W的最高价氧化物对应的水化物的酸性比Q的强 |
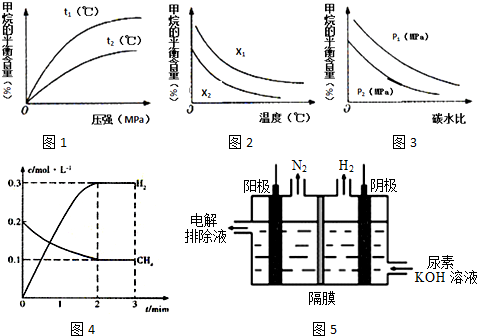
(1)写出甲烷与水蒸气在高温下反应制合成气的热化学方程式CH4(g)+H2O(g)=CO(g)+3H2(g)△H=+206.1kJ•mol-1.
(2)在一定条件下,向体积固定为2L的密闭容器中充入0.40mol CH4(g)和0.60mol H2O(g),测得CH4(g)和H2(g)的物质的量浓度随时间变化的曲线如图4所示.
3min时改变条件,反应进行到t1min时,体系中各物质的物质的量如下表所示:
| t/min | n(CH4)/mol | n(H2O)/mol | n(CO)/mol | n(H2)/mol |
| t1 | 0.18 | 0.38 | 0.22 | 0.66 |
(3)已知温度、压强和碳水比[$\frac{n(C{H}_{4})}{n({H}_{2}O)}$]对该反应的影响如图所示.
①图l中,两条曲线所示温度的关系:t1<t2(填“>”、“<”或“=”,下同).
②图2中,两条曲线所示碳水比的关系:x1>x2.
③图3中,两条曲线所示压强的关系:p1>p2.
(4)氢气也可利用电解尿素制备.电解尿素[CO(NH2)2]的碱性溶液制氢的装置示意图5图(电解池中隔膜仅阻止气体通过,阴、阳极均为惰性电极).电解时,阳极的电极反应式为CO(NH2)2+8OH--6e-=CO32-+N2↑+6H2O.
 SO2的烟气会形成酸雨,危害环境.利用钠碱循环法可脱除烟气中的SO2.
SO2的烟气会形成酸雨,危害环境.利用钠碱循环法可脱除烟气中的SO2.(1)在钠碱循环法中,Na2SO3溶液作为吸收液,可由NaOH溶液吸收SO2制得,该反应的离子方程式是2OH-+SO2=SO32-+H2O.
(2)吸收液吸收SO2的过程中,pH随n(SO32-),n(HSO3-)变化关系如表:
| n(SO32-):,n(HSO3-) | 91:9 | 1:1 | 1:91 |
| PH | 8.2 | 7.2 | 6.2 |
②当吸收液呈中性时,溶液中离子浓度关系正确的是(选填字母):ab
a.c(Na-)=2c(SO3-)+c(HSO32-)
b.c(Na-)>c(HSO3-)>c(SO32-)>c(H-)=c(OH-)
c.c(Na+)+c(H+)=c(SO32-)+c(HSO3-)+c(OH-)
(3)当吸收液的pH降至约为6时,送至电解槽再生.再生示意图如下:
①HSO3-在阳极放电的电极反应式是HSO3-+H2O-2e-=SO42-+3H+.
②当阴极室中溶液PH升至8以上时,吸收液再生并循环利用.简述再生原理:氢离子在阴极得电子生成氢气,溶液中氢离子浓度降低,促使HSO3-电离生成SO32-,且钠离子进入阴极室,吸收液就可以再生.
| A. | 简单阳离子的氧化性:Z>X | |
| B. | 气态氢化物的稳定性:M>Y | |
| C. | 简单离子半径由大到小的顺序是:M>Y>Z | |
| D. | 在X2M与Z2M的溶液中,水的电离程度,前者大于后者 |
| A. | 0.80 | B. | 0.85 | C. | 0.90 | D. | 0.93 |
 、
、 、
、 ;C6H5OCH3.
;C6H5OCH3.