题目内容
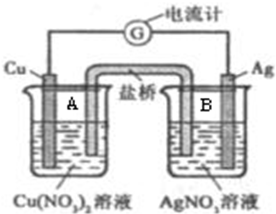 某原电池构造如图所示.其电池的总反应是:Cu(s)+2Ag+(aq)=Cu2+(aq)+2Ag(s).请回答以下问题:
某原电池构造如图所示.其电池的总反应是:Cu(s)+2Ag+(aq)=Cu2+(aq)+2Ag(s).请回答以下问题:(1)若盐桥为琼脂-KNO3组成,则NO3-离子移向
(2)把盐桥改为铜棒后,电流计的指针
考点:原电池和电解池的工作原理
专题:
分析:(1)由总反应及原电池装置可知,Cu为负极,Cu失去电子后铜离子浓度增大,Ag为正极,阴离子向负极移动;
(2)把盐桥改为铜棒后,装置B为原电池,装置A为电解池,电解硫酸铜溶液,阳极为铜,铜失去电子.
(2)把盐桥改为铜棒后,装置B为原电池,装置A为电解池,电解硫酸铜溶液,阳极为铜,铜失去电子.
解答:
解:(1)盐桥为琼脂-KOH组成,能够使两个烧杯中的溶液连成通路,使电路形成闭合回路,铜反应中失去电子被氧化,电极反应为:Cu-2e-═Cu2+,属于原电池负极,则NO3-离子移向A,电流从银经外电路流向铜,氢氧根离子带负电荷,与电路方向相反,OH-离子移向A溶液;A中的电解质溶液,铜失去电子生成了铜离子,在该电池工作一段时间后会出现A溶液中出现蓝色沉淀,
故答案为:A;负;Cu-2e-═Cu2+;出现蓝色沉淀;
(2)把盐桥改为铜棒后,装置B为原电池,装置A为电解池,电解硫酸铜溶液,阳极为铜,铜失去电子铜离子,阴极铜离子得到电子生成铜,电流计的指针会偏转,硫酸铜浓度不变,
故答案为:会;电解池;不变.
故答案为:A;负;Cu-2e-═Cu2+;出现蓝色沉淀;
(2)把盐桥改为铜棒后,装置B为原电池,装置A为电解池,电解硫酸铜溶液,阳极为铜,铜失去电子铜离子,阴极铜离子得到电子生成铜,电流计的指针会偏转,硫酸铜浓度不变,
故答案为:会;电解池;不变.
点评:本题考查原电池原理,为高频考点,把握原电池时的形成条件、原电池的电池反应式判断正负极及电解质溶液为解答的关键,(2)为解答的难点,题目难度较大.

练习册系列答案
 励耘书业暑假衔接宁波出版社系列答案
励耘书业暑假衔接宁波出版社系列答案
相关题目
一定量的Fe、FeO、Fe2O3、Fe3O4的混合物中加入350mL 2mol?L-1的稀硝酸恰好使混合物完全溶解,放出2.24L NO(标准状况),往所得溶液中加入KSCN溶液,无红色出现.若用足量的H2在加热条件下还原相同质量的混合物,所得到的铁的物质的量为( )
| A、0.21 mol |
| B、0.25 mol |
| C、0.3 mol |
| D、0.35 mol |
常温下,下列事实能说明HClO是弱电解质的是( )
| A、NaClO、HClO都易溶于水 |
| B、HClO与Na2SO3溶液反应,可以得到Na2SO4 |
| C、NaClO的电离方程式:NaClO=Na++ClO- |
| D、0.01 mol?L-1 的HClO溶液pH>2 |
下列各组物质中,都是强电解质的是( )
| A、NaOH、Ca(OH)2、NH3?H2O |
| B、NH4Cl、CH3COOH、Na2S |
| C、HBr、HCl、BaSO4 |
| D、HClO、NaF、Ba(OH)2 |
铍元素性质与铝元素性质相似,下列方法能证明氯化铍是分子晶体的是( )
| A、溶于硝酸银溶液,观察是否有白色沉淀生成 |
| B、溶于水做导电实验,观察是否导电 |
| C、熔融状态,做导电实验,观察是否导电 |
| D、测定氯化铍熔点 |
下列化学式与指定物质的主要成分对应正确的是( )
| A、CH4--天然气 |
| B、CO2--水煤气 |
| C、CaCO3--石膏粉 |
| D、NaHCO3--苏打粉 |
下列物质属于纯净物的是( )
| A、福尔马林 | B、聚氯乙烯 |
| C、纤维素 | D、硬脂酸甘油酯 |