题目内容
某学生以铁丝和Cl2为原料进行下列三个实验.从分类角度下列分析正确的是( )

| A、实验①、③反应制得的物质均为纯净物 |
| B、实验②、③均未发生氧化还原反应 |
| C、实验②、③均为放热反应 |
| D、实验①、②所涉及的物质均为电解质 |
考点:氯气的化学性质
专题:卤族元素
分析:A、③得到的是氢氧化铁胶体,是混合体系;
B、实验②溶解主要是物理变化、③水解是复分解,两者均未发生氧化还原反应;
C、盐的水解是吸热反应;
D、实验①中的铁和氯气是单质既不是电解质也不是非电解质.
B、实验②溶解主要是物理变化、③水解是复分解,两者均未发生氧化还原反应;
C、盐的水解是吸热反应;
D、实验①中的铁和氯气是单质既不是电解质也不是非电解质.
解答:
解:A、③得到的是氢氧化铁胶体,是混合体系,所以不全为纯净物,故A错误;
B、实验②溶解主要是物理变化、③水解是复分解,两者均未发生氧化还原反应,故B正确;
C、盐的水解是吸热反应,故C错误;
D、实验①中的铁和氯气是单质,既不是电解质也不是非电解质,故D错误;
故选B.
B、实验②溶解主要是物理变化、③水解是复分解,两者均未发生氧化还原反应,故B正确;
C、盐的水解是吸热反应,故C错误;
D、实验①中的铁和氯气是单质,既不是电解质也不是非电解质,故D错误;
故选B.
点评:本题考查物质的分类、氧化还原、热效应和电解质的相关概念,比较基础.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
丁腈橡胶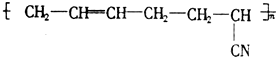 具有优良的耐油、耐高温性能,合成丁腈橡胶的原料是( )
具有优良的耐油、耐高温性能,合成丁腈橡胶的原料是( )
①CH2=CH-CH=CH2
②CH3-C≡C-CH3
③CH2=CH-CN
④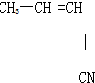
⑤CH3-CH═CH2
⑥CH3-CH=CH-CH.
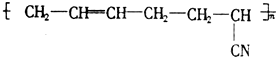 具有优良的耐油、耐高温性能,合成丁腈橡胶的原料是( )
具有优良的耐油、耐高温性能,合成丁腈橡胶的原料是( )①CH2=CH-CH=CH2
②CH3-C≡C-CH3
③CH2=CH-CN
④
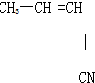
⑤CH3-CH═CH2
⑥CH3-CH=CH-CH.
| A、③⑥ | B、②③ | C、①③ | D、④⑤ |
反应条件对化学反应具有影响作用,下列说法中正确的是( )
| A、镁在空气中或纯净氧气中燃烧的产物都只有MgO |
| B、钠在敞口容器中存放或在空气中燃烧的产物都是Na2O2 |
| C、将四氧化三铁溶解于过量的硝酸,所得溶液中含有Fe3+、Fe2+ |
| D、偏铝酸钠和少量的二氧化碳反应一定得到Al(OH)3沉淀 |
已知25℃,醋酸、次氯酸、碳酸、亚硫酸的电离平衡常数如下表,下列叙述正确的是( )
| 酸 | 醋酸 | 次氯酸 | 碳酸 | 亚硫酸 |
| 电离平衡常数 | Ka=1.75×10-5 | Ka=2.98×10-8 | Ka1=4.30×10-7Ka2=5.61×10-11 | Ka1=1.54×10-2 Ka2=1.02×10-7 |
| A、25℃,等物质的量浓度的CH3COONa、NaClO、Na2CO3和Na2SO3 四种溶液中,碱性最强的是Na2CO3 |
| B、将0.1 mol?L-1的醋酸加水不断稀释,所有离子浓度均减小 |
| C、少量的SO2通入Ca(ClO)2溶液中反应的离子方程式为:SO2+H2O+Ca2++2ClO-=CaSO3↓+2HClO |
| D、少量CO2通入NaClO溶液中反应的离子方程式为:CO2+H2O+2ClO-=CO32-+2HClO |
下列现象中,能用范德华力解释的是( )
| A、氮气的化学性质稳定 |
| B、通常状况下,溴呈液态,碘呈固态 |
| C、水的沸点比硫化氢高 |
| D、锂的熔点比钠高 |
物质在化学反应前后,可能发生变化的是( )
| A、原子总数 | B、质子总数 |
| C、电子总数 | D、分子总数 |