题目内容
15.FeCO3与砂糖混用可以作补血剂,实验室里制备FeCO3的流程如图所示.下列说法错误的是( )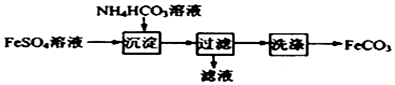
| A. | 产品FeCO3在空气中高温分解可得到纯净的FeO | |
| B. | 可利用KSCN溶液检验FeSO4溶液是否变质 | |
| C. | 沉淀过程中有CO2气体放出 | |
| D. | 检验沉淀是否洗涤干净可用盐酸酸化的BaCl2溶液 |
分析 FeSO4溶液中加碳酸氢铵生成FeCO3,过滤、洗涤,即可得到FeCO3固体.
A.二价铁在空气中加热易被氧化为三价铁;
B.亚铁离子变质会生成铁离子,利用KSCN溶液检;
C.FeSO4与碳酸氢铵发生的反应为:Fe2++2HCO3-=FeCO3↓+H2O+CO2↑,以此判断;
D.沉淀表面吸附硫酸根离子,可用钡离子检验.
解答 解:A.二价铁在空气中加热易被氧化为三价铁,所以FeCO3在空气中高温分解不能得到FeO,故A错误;
B.亚铁离子变质会生成铁离子,则验FeSO4溶液若变质会生成铁离子,可利用KSCN溶液检,故B正确;
C.FeSO4与碳酸氢铵发生的反应为:Fe2++2HCO3-=FeCO3↓+H2O+CO2↑,则沉淀过程中有CO2气体放出,故C正确;
D.沉淀表面吸附硫酸根离子,可用钡离子检验,故D正确.
故选A.
点评 本题考查物质的制备,为高频考点,侧重于学生的分析能力和实验能力的考查,题目涉及过滤操作、铁的化合物的性质及检验,题目难度不大,注意把握二价铁的性质以及铁离子的检验方法.

练习册系列答案
 全优考典单元检测卷及归类总复习系列答案
全优考典单元检测卷及归类总复习系列答案 品学双优卷系列答案
品学双优卷系列答案 小学期末冲刺100分系列答案
小学期末冲刺100分系列答案
相关题目
5.在固定容积的密闭容器中,放入amolX,发生反应:2X?Y(g)+Z(s),并达到平衡状态,此时升高温度,气体的密度增大.下列叙述正确的是( )
| A. | 平衡后移走部分Z,平衡正向移动 | |
| B. | 若正反应为放热反应,则X一定为气态 | |
| C. | 若X为非气态,则正反应为放热反应 | |
| D. | 若X为气态,再向容器中充入amolX,达到平衡后,X的体积分数增大 |
6.在一真空容器中,充入10mol N2,30mol H2,发生反应N2(g)+3H2(g)?2NH3(g),在一定条件下达到平衡时,N2的转化率为25%.若在同一容器中,在相同温度下,向容器中充入NH3,欲使达到平衡时各成分的质量分数与上述平衡相同,则起始时NH3的量和达到平衡时NH3的转化率为( )
| A. | 20 mol、25% | B. | 20 mol、75% | C. | 40 mol、30% | D. | 10mol、50% |
10.设NA为阿伏加德罗常数,下列说法正确的是( )
| A. | 标准状况下,5.6L CCl4含有的分子数为0.25NA | |
| B. | 标准状况下,14 g氮气含有的核外电子数为5NA | |
| C. | 标准状况下,22.4 L任意比的氢气和氯气的混气中含有分子总数均为NA | |
| D. | 在标准状况下,18gH2O所含有的电子数不是10NA |
7.下列有关实验操作和实验事故处理不正确的是( )
| A. | 用蘸浓盐酸的玻璃棒靠近盛放氨气的装置,检查是否漏气 | |
| B. | 浓硫酸沾在皮肤上,立刻用稀氢氧化钠溶液冲洗 | |
| C. | 液溴应保存在棕色磨口玻璃塞的试剂瓶中,并加少量水进行水封 | |
| D. | 为防止被氧化,FeSO4溶液存放在加有少量铁粉的试剂瓶中 |

 ,该反应的反应类型为加成反应
,该反应的反应类型为加成反应 
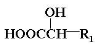 上的羟基可以氧化成羰基,再脱羧变成醛;
上的羟基可以氧化成羰基,再脱羧变成醛; (R1、R2、R3和R4表示烃基或氢),且姜黄素具有称结构.由G制取姜黄素的化学方程式为
(R1、R2、R3和R4表示烃基或氢),且姜黄素具有称结构.由G制取姜黄素的化学方程式为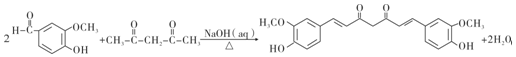
 可用于合成有机高分子色素,根据Claisen缩合反应,设计
可用于合成有机高分子色素,根据Claisen缩合反应,设计 .
.