题目内容
1.聚合氯化铝是新型、高效絮凝剂和净水剂,其单体是液态碱式氯化铝[Al2(OH)nCl6-n].工业上常采用铝盐溶液部分水解制备碱式氯化铝,其工艺流程如下: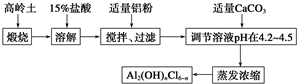
已知:高岭土:Al2O3(25%~34%)、SiO2(40%~50%)、Fe2O3(0.5%~3.0%)及少量杂质和水.Al3+以氢氧化物形式完全沉淀时,溶液的pH为5.2.根据流程图回答下列问题:
(1)写出溶解过程中反应的离子方程式Al2O3+6H+=2Al3++3H2O;Fe2O3+6H+=2Fe3++3H2O.
(2)加适量铝粉的主要目的是除去溶液中的铁元素.
(3)溶液的pH需控制在4.2~4.5的原因是pH超过4.5,Al3+会形成Al(OH)3沉淀,pH低于4.2,Al3+水解程度很小,很难形成液态碱式氯化铝[Al2(OH)nCl6-n].
(4)“蒸发浓缩”需保持温度在90~100℃,控制该温度的操作名称是水浴加热,写出该过程反应的化学方程式2AlCl3+nH2O═Al2(OH)nCl6-n+nHCl.
分析 加入盐酸,二氧化硅不反应,Al2O3、Fe2O3与盐酸反应生成氯化铝、氯化铁,加入适量铝粉,过滤,除去溶液中的铁离子,在滤液中加入适量碳酸钙调节pH在4.2~4.5,将溶液蒸发浓缩,可得到[Al2(OH)nCl6-n],以此解答该题.
解答 解:加入盐酸,二氧化硅不反应,Al2O3、Fe2O3与盐酸反应生成氯化铝、氯化铁,加入适量铝粉,过滤,除去溶液中的铁离子,在滤液中加入适量碳酸钙调节pH在4.2~4.5,将溶液蒸发浓缩,可得到[Al2(OH)nCl6-n],
(1)“溶解”过程反应的离子方程式有 Al2O3+6H+=2Al3++3H2O、Fe2O3+6H+=2Fe3++3H2O,故答案为:Al2O3+6H+=2Al3++3H2O、Fe2O3+6H+=2Fe3++3H2O;
(2)铝可与铁离子反应生成亚铁离子,铝与亚铁离子反应置换出铁,加入铝粉最主要作用是:除去溶液中的铁元素,故答案为:除去溶液中的铁元素;
(3)将滤液3的pH调至4.2~4.5,利用水解反应得到液体聚合氯化铝,防止生成氢氧化铝沉淀,实验时pH超过4.5,Al3+会形成Al(OH)3沉淀;pH低于4.2,Al3+水解程度很小,很难形成液态碱式氯化铝[Al2(OH)nCl6-n],
故答案为:pH超过4.5,Al3+会形成Al(OH)3沉淀;pH低于4.2,Al3+水解程度很小,很难形成液态碱式氯化铝[Al2(OH)nCl6-n];
(4)控制该温度在一定范围之间,可水浴加热,氯化铝水解生成Al2(OH)nCl6-n,反应的化学方程式为2AlCl3+nH2O═Al2(OH)nCl6-n+nHCl,
故答案为:水浴加热;2AlCl3+nH2O═Al2(OH)nCl6-n+nHCl.
点评 本题考查了物质制备方法和实验探究,为高频考点,掌握实验基本操作和理解实验原理是解题关键,题目难度中等,需要学生具备扎实的基础,难度中等.

| A. | Al3+、ClO-、Cl- | B. | Na+、NH4+、Cl- | C. | Mg2+、Cl-、Fe2+ | D. | Mg2+、Ba2+、Br- |
 如右图所示,集气瓶 内充满某混合气体,置于光亮处,将滴管内的水挤入集气瓶后,烧杯中的水会进入集气瓶,集气瓶内气体是( )
如右图所示,集气瓶 内充满某混合气体,置于光亮处,将滴管内的水挤入集气瓶后,烧杯中的水会进入集气瓶,集气瓶内气体是( )①CO、O2 ②Cl2、NH3 ③NO2、O2 ④N2、H2.
| A. | ①② | B. | ②④ | C. | ②③ | D. | ③④ |
 (2,4-二甲基-1-庚烯),
(2,4-二甲基-1-庚烯), (3,7-二甲基-1-辛烯),家蚕的性信息素为:CH3(CH2)3CH=CH-CH=CH(CH2)3CH3.下列说法正确的是( )
(3,7-二甲基-1-辛烯),家蚕的性信息素为:CH3(CH2)3CH=CH-CH=CH(CH2)3CH3.下列说法正确的是( )| A. | 以上三种信息素互为同系物 | |
| B. | 以上三种信息素均能使溴的四氯化碳溶液褪色 | |
| C. | 2,4-二甲基-1-庚烯与3,7-二甲基-1-辛烯互为同分异构体 | |
| D. | 家蚕的性信息素与1molBr2加成产物只有一种 |
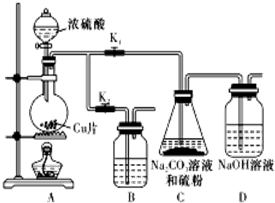 硫代硫酸钠(Na2S2O3)可由亚硫酸钠和硫粉通过化合反应制得.已知:Na2S2O3在酸性溶液中不能稳定存在.
硫代硫酸钠(Na2S2O3)可由亚硫酸钠和硫粉通过化合反应制得.已知:Na2S2O3在酸性溶液中不能稳定存在.(1)某研究小组设计了制备Na2S2O3•5H2O的装置和部分操作步骤如下.
Ⅰ.打开Kl,并闭K2,向圆底烧瓶中加人足量浓硫酸,加热.
Ⅱ.C中的混合液被气流搅动,反应一段时间后,硫粉的量逐渐减少.当C中溶液的pH接近7时即停止C中的反应.
Ⅲ.过滤C中的混合液.
Ⅳ.将滤液加热浓缩、冷却结晶、过滤、洗涤、烘干,得到产品.
①I中,圆底烧瓶中发生反应的化学方程式是:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O.
②Ⅱ中“停止C中的反应”的操作是打开K2,关闭K1.
③Ⅳ中将滤液加热浓缩、冷却结晶、过滤、洗涤、烘干,得到产品.Na2S2O3•5H2O的溶解度随温度升高显著增大,所得产品通过重结晶方法提纯.
④装置B的作用是在C中的反应停止后吸收A中产生的多余SO2防止空气污染.
(2)依据反应2S2O32-+I2═S4O62-+2I-,可用I2的标准溶液测定产品的纯度.取5.5g产品,配制成100mL溶液.取10mL溶液,以淀粉溶液为指示剂,用浓度为0.050mol•L-1I2的标准溶液进行滴定,相关数据记录如下表所示.
| 编号 | 1 | 2 | 3 | 4 |
| 溶液的体积/mL | 10.00 | 10.00 | 10.00 | 10.00 |
| 消耗I2标准溶液的体积/mL | 19.99 | 19.98 | 17.13 | 20.03 |
②Na2S2O3•5H2O在产品中的质量分数是90.2%(Na2S2O3•5H2O的式量为248,计算结果保留1位小数).
| 弱酸化学式 | CH3COOH | HCN | H2CO3 |
| 电离平衡常数(25℃) | 1.8×l0-5 | 4.9×l0-10 | K1=4.3×l0-7K2=5.6×l0-11 |
| A. | 向NaCN 溶液中通入少量CO2发生的离子反应为:2CN-+H2O+CO2═2HCN+CO32- | |
| B. | 等物质的量浓度的各溶液pH关系为:pH(NaCN)>pH(Na2CO3)>pH(CH3COONa) | |
| C. | a mol/LHCN溶液与b mol/LNaOH溶液等体积混合后,所得溶液中c(Na+)>c(CN-),则b一定大 于a | |
| D. | NaHCO3和Na2CO3的混合溶液中,一定存在:c(Na+)+c(H+)=c(OH-)+c(HCO3-)+2c(CO32-) |
| A. | 1mol KClO3 参加反应有2mol电子转移 | |
| B. | ClO2是氧化产物 | |
| C. | H2C2O4的氧化性强于ClO2的氧化性 | |
| D. | KClO3 在反应中得到电子,作氧化剂 |
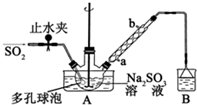 次硫酸氢钠甲醛(NaHSO2•HCHO•2H2O)俗称吊白块,不稳定,120℃时会分解,在印染、医药以及原子能工业中有广泛应用.以Na2SO3、SO2、HCHO和锌粉为原料制备次硫酸氢钠甲醛的实验步骤如图:
次硫酸氢钠甲醛(NaHSO2•HCHO•2H2O)俗称吊白块,不稳定,120℃时会分解,在印染、医药以及原子能工业中有广泛应用.以Na2SO3、SO2、HCHO和锌粉为原料制备次硫酸氢钠甲醛的实验步骤如图: