题目内容
20.德国卡尔•肖莱马是有机化学的奠基人和杰出的有机化学理论家.他的主要贡献是对脂肪烃的系统研究并解决了烷烃的异构理论.根据下表中烃的分子式排列规律,判断空格中烃的同分异构体数目是( )| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| CH4 | C2H4 | C3H8 | C4H8 | C6H12 | C7H16 | C8H16 |
| A. | 3 | B. | 4 | C. | 5 | D. | 6 |
分析 由表中烃的排列规律可知,5对应有机物含有5个C原子,再结合1与2、3与4、7与8的H原子个数相等可知该有机物分子中含有12个H,分子式应为C5H12,是戊烷,戊烷存在正戊烷、异戊烷和新戊烷三种同分异构体.
解答 解:从1到8,物质的分子中C原子个数递增,因此物质5的分子中应含有5个碳原子;
各物质的分子构成中H原子符合1与2、3与4、7与8的H原子个数相等,则可推断5与6的分子构成中H原子个数相等,即物质5的分子中含有12个H原子;
综合以上分析,物质5的化学式为C5H12,同分异构体有正、异、新3种,
故选A.
点评 本题考查了有机物分子式组成的判断、同分异构体数目的求算,题目难度不大,对比化学式发现物质组成找出存在的规律为解答本题的关键,试题考查了学生归纳与整理的能力

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
10.25℃时,弱酸的电离平衡常数如下表,下列说法正确的是( )
| 弱酸化学式 | CH3COOH | HCN | H2CO3 |
| 电离平衡常数(25℃) | 1.8×l0-5 | 4.9×l0-10 | K1=4.3×l0-7K2=5.6×l0-11 |
| A. | 向NaCN 溶液中通入少量CO2发生的离子反应为:2CN-+H2O+CO2═2HCN+CO32- | |
| B. | 等物质的量浓度的各溶液pH关系为:pH(NaCN)>pH(Na2CO3)>pH(CH3COONa) | |
| C. | a mol/LHCN溶液与b mol/LNaOH溶液等体积混合后,所得溶液中c(Na+)>c(CN-),则b一定大 于a | |
| D. | NaHCO3和Na2CO3的混合溶液中,一定存在:c(Na+)+c(H+)=c(OH-)+c(HCO3-)+2c(CO32-) |
11.ClO2是一种消毒杀菌效率高、二次污染小的水处理剂.实验室可通过以下反应制得ClO2:2KClO3+H2C2O4+H2SO4$\frac{△}{\;}$2ClO2↑+K2SO4+2CO2↑+2H2O,下列说法正确的是( )
| A. | 1mol KClO3 参加反应有2mol电子转移 | |
| B. | ClO2是氧化产物 | |
| C. | H2C2O4的氧化性强于ClO2的氧化性 | |
| D. | KClO3 在反应中得到电子,作氧化剂 |
15.A、B、C、D、E为原子序数依次增大的五种短周期元素.A的质子总数与电子层数相同,B、C、D同周期且相邻,E原子核外电子数是D原子最外层电子数的2倍.C与其同主族的短周期元素可形成常见气体甲.A、B、C3种元素形成化合物乙.下列说法正确的是( )
| A. | 原子半径:E>B>C>D | |
| B. | A分别与B、C、D、E形成的简单化合物中,稳定性最好的和沸点最高的都是AD | |
| C. | E单质性质稳定,但其元素在自然界只能以化合态形式存在 | |
| D. | 化合物乙中一定含有共价键,可能含有离子键 |
5.含有2~5个碳原子的直链烷烃沸点和燃烧热的数据见下表:( )
*燃烧热:1mol物质完全燃烧,生成二氧化碳、液态水时所放出的热量.根据表中数据,下列判断错误的是( )
| 烷烃名称 | 乙烷 | 丙烷 | 丁烷 | 戊烷 |
| 沸点(℃) | -88.6 | -42.1 | -0.5 | 36.1 |
| *燃烧热(kJ•mol-1) | 1560.7 | 2219.2 | 2877.6 | 3535.6 |
| A. | 正庚烷在常温常压下肯定不是气体 | |
| B. | 直链烷烃燃烧热和其所含碳原子数呈线性关系 | |
| C. | 随碳原子数增加,直链烷烃沸点逐渐升高 | |
| D. | 随碳原子数增加,直链烷烃沸点和燃烧热都成比例增加 |
12.一定能在下列溶液中大量共存的离子组是( )
| A. | 水电离产生的H+浓度为1×10-12mol•L-1的溶液:NH4+、Na+、Cl-、HCO3- | |
| B. | 能使pH试纸变深蓝色的溶液:Na+、AlO2-、S2-、CO32- | |
| C. | 含有大量Fe3+的溶液:SCN-、I-、K+、Br- | |
| D. | pH=1的水溶液中:Al3+、NH4+、CH3COO-、Br- |
9.在一定条件下,Na2CO3溶液存在水解平衡:CO32-+H2O?HCO3-+OH-,下列说法正确的是( )
| A. | 稀释溶液,水解平衡常数增大 | |
| B. | 升高温度,C(CO32-) 减小 | |
| C. | 稀释溶液,溶液中所有离子浓度均减小 | |
| D. | 加入NaOH(s),溶液pH减小 |
10.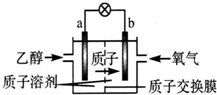 一种新型的乙醇电池(DEFC)是用磺酸类质子溶剂作电解质,在200℃左右时供电(如图所示),比甲醇电池效率高出32倍,且安全.电池总反应为C2H5OH+3O2═2CO2+3H2O.则下列说法正确的是( )
一种新型的乙醇电池(DEFC)是用磺酸类质子溶剂作电解质,在200℃左右时供电(如图所示),比甲醇电池效率高出32倍,且安全.电池总反应为C2H5OH+3O2═2CO2+3H2O.则下列说法正确的是( )
 一种新型的乙醇电池(DEFC)是用磺酸类质子溶剂作电解质,在200℃左右时供电(如图所示),比甲醇电池效率高出32倍,且安全.电池总反应为C2H5OH+3O2═2CO2+3H2O.则下列说法正确的是( )
一种新型的乙醇电池(DEFC)是用磺酸类质子溶剂作电解质,在200℃左右时供电(如图所示),比甲醇电池效率高出32倍,且安全.电池总反应为C2H5OH+3O2═2CO2+3H2O.则下列说法正确的是( )| A. | a极为电池的正极 | |
| B. | 电池正极的电极反应:4H++O2+4e-═2H2O | |
| C. | 电池工作时电子由b极沿导线经灯泡再到a极 | |
| D. | 设每个电子所带电量为q库仑,则1 mol乙醇被氧化产生12q库仑的电量 |
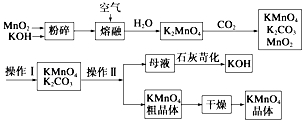 高锰酸钾可用于生活消毒,是中学化学常见的氧化剂.工业上,用软锰矿制高锰酸钾的流程如下:
高锰酸钾可用于生活消毒,是中学化学常见的氧化剂.工业上,用软锰矿制高锰酸钾的流程如下: