题目内容
18.氯酸镁[Mg(ClO3)2]常用作催熟剂、除草剂等,实验室制备少量Mg(ClO3)2•6H2O的流程如下: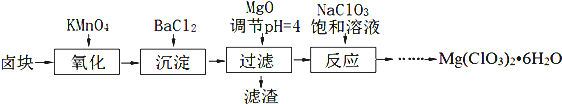
已知:①卤块主要成分为MgCl2•6H2O,含有MgSO4、FeCl2等杂质.
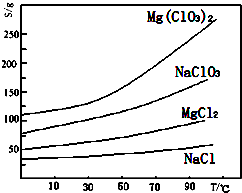
②几种化合物的溶解度(S)随温度(T)变化曲线如图所示.
(1)过滤所需要的主要玻璃仪器有漏斗、玻璃棒、烧杯,加MgO后过滤所得滤渣的主要成分为BaSO4和Fe(OH)3.
(2)加入BaCl2的目的是除去SO42-,如何检验SO42-已沉淀完全?
答:静置,取上层清液加入BaCl2,若无白色沉淀,则SO42-沉淀完全.
(3)加入NaClO3饱和溶液发生反应为:MgCl2+2NaClO3═Mg(ClO3)2+2NaCl↓
再进一步制取Mg(ClO3)2•6H2O的实验步骤依次为:
①蒸发结晶;②趁热过滤;③冷却结晶;④过滤、洗涤.
(4)产品中Mg(ClO3)2•6H2O含量的测定:
步骤1:准确称量3.50g产品配成100mL溶液.
步骤2:取10mL于锥形瓶中,加入10mL稀硫酸和20mL 1.000mol•L-1的FeSO4溶液,微热.
步骤3:冷却至室温,用0.100mol•L-1 K2Cr2O7溶液滴定至终点,此过程中反应的离子方程式为:Cr2O72-+6Fe2++14H+═2Cr3++6Fe3++7H2O.
步骤4:将步骤2、3重复两次,平均消耗K2Cr2O7溶液15.00mL.
①写出步骤2中发生反应的离子方程式:ClO3-+6Fe2++6H+=6Fe3++Cl-+3H2O.
②产品中Mg(ClO3)2•6H2O的质量分数为78.3%.
分析 (1)过滤实验用到的仪器:漏斗、玻璃棒、烧杯、滤纸、铁架台等,根据加氧化镁后溶液的pH为4,可以沉淀的离子来回答;
(2)根据钡离子可以和硫酸根离子之间反应生成白色不溶于硝酸的白色沉淀来回答;
(3)根据物质的溶解度大小,溶液获得晶体的方法:蒸发结晶、过滤、冷却结晶;
(4)氯酸根离子具有氧化性,可以将亚铁离子氧化为正三价;根据化学反应得出各个质物之间的关系式,计算百分含量.
解答 解:(1))过滤实验用到的仪器:漏斗、玻璃棒、烧杯、滤纸、铁架台等,其中玻璃仪器有:漏斗、玻璃棒、烧杯,加入氧化镁,调节溶液的pH为4,此时铁离子形成了沉淀氢氧化铁,钡离子已经和硫酸根离子只碱反应生成了硫酸钡沉淀,
故答案为:漏斗、玻璃棒、烧杯;BaSO4和Fe(OH)3;
(2)检验硫酸根离子是否除净的方法:静置,取上层清液加入BaCl2,若无白色沉淀,则SO42-沉淀完全,
故答案为:静置,取上层清液加入BaCl2,若无白色沉淀,则SO42-沉淀完全;
(3)根据物质的溶解度大小,溶液获得晶体的方法:蒸发结晶、过滤、冷却结晶,
故答案为:蒸发结晶;趁热过滤;冷却结晶;
(4)①氯酸根离子具有氧化性,可以将亚铁离子氧化为正三价,化学方程式为:ClO3-+6Fe2++6H+=6Fe3++Cl-+3H2O,
故答案为:ClO3-+6Fe2++6H+=6Fe3++Cl-+3H2O;
②根据化学方程式:ClO3-+6Fe2++6H+=6Fe3++Cl-+3H2O以及Cr2O72-+6Fe2++14H+═2Cr3++6Fe3++7H2O,可以得出:
ClO3-~6Fe2+,Cr2O72-~6Fe2+,用0.100mol•L-1 K2Cr2O7溶液滴定至终点过程可以得出剩余的亚铁离子的物质的量为:0.100mol•L-1×0.015L×6=0.009mol,和氯酸根离子反应的亚铁离子的物质的量为:20×10-3L×1.000mol•L-1-0.009mol=0.011mol,
氯酸根离子的物质的量为:$\frac{1}{6}$×0.011mol,产品中Mg(ClO3)2•6H2O的质量分数:($\frac{1}{2}$×0.011×299g/mol)×10×$\frac{1}{3.5}$×100%=78.3%.
故答案为:78.3%.
点评 本题考查对常见金属元素及其化合物主要性质的掌握,以及对离子反应实质的认识;同时考查应用基础知识解决简单化学问题的能力以及对图表的观察、分析能力,物质溶解度概念的应用,晶体析出的方法,杂质离子的除杂原则和试剂选择,题目难度中等.

 阅读快车系列答案
阅读快车系列答案| A. | 按系统命名法,化合物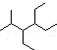 的名称为2-甲基-3,4-二乙基己烷 的名称为2-甲基-3,4-二乙基己烷 | |
| B. | 等质量的甲烷、乙醇、乙醛分别充分燃烧,所耗用氧气的量依次减小 | |
| C. | 下列物质的沸点按由低到高顺序为:(CH3)2CHCH3<(CH3)4C<(CH3)2CHCH2CH3<CH3(CH2)3CH3 | |
| D. | 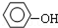 与 与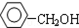 互为同系物 互为同系物 |
 (2,4-二甲基-1-庚烯),
(2,4-二甲基-1-庚烯), (3,7-二甲基-1-辛烯),家蚕的性信息素为:CH3(CH2)3CH=CH-CH=CH(CH2)3CH3.下列说法正确的是( )
(3,7-二甲基-1-辛烯),家蚕的性信息素为:CH3(CH2)3CH=CH-CH=CH(CH2)3CH3.下列说法正确的是( )| A. | 以上三种信息素互为同系物 | |
| B. | 以上三种信息素均能使溴的四氯化碳溶液褪色 | |
| C. | 2,4-二甲基-1-庚烯与3,7-二甲基-1-辛烯互为同分异构体 | |
| D. | 家蚕的性信息素与1molBr2加成产物只有一种 |
 硫代硫酸钠(Na2S2O3)可由亚硫酸钠和硫粉通过化合反应制得.已知:Na2S2O3在酸性溶液中不能稳定存在.
硫代硫酸钠(Na2S2O3)可由亚硫酸钠和硫粉通过化合反应制得.已知:Na2S2O3在酸性溶液中不能稳定存在.(1)某研究小组设计了制备Na2S2O3•5H2O的装置和部分操作步骤如下.
Ⅰ.打开Kl,并闭K2,向圆底烧瓶中加人足量浓硫酸,加热.
Ⅱ.C中的混合液被气流搅动,反应一段时间后,硫粉的量逐渐减少.当C中溶液的pH接近7时即停止C中的反应.
Ⅲ.过滤C中的混合液.
Ⅳ.将滤液加热浓缩、冷却结晶、过滤、洗涤、烘干,得到产品.
①I中,圆底烧瓶中发生反应的化学方程式是:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O.
②Ⅱ中“停止C中的反应”的操作是打开K2,关闭K1.
③Ⅳ中将滤液加热浓缩、冷却结晶、过滤、洗涤、烘干,得到产品.Na2S2O3•5H2O的溶解度随温度升高显著增大,所得产品通过重结晶方法提纯.
④装置B的作用是在C中的反应停止后吸收A中产生的多余SO2防止空气污染.
(2)依据反应2S2O32-+I2═S4O62-+2I-,可用I2的标准溶液测定产品的纯度.取5.5g产品,配制成100mL溶液.取10mL溶液,以淀粉溶液为指示剂,用浓度为0.050mol•L-1I2的标准溶液进行滴定,相关数据记录如下表所示.
| 编号 | 1 | 2 | 3 | 4 |
| 溶液的体积/mL | 10.00 | 10.00 | 10.00 | 10.00 |
| 消耗I2标准溶液的体积/mL | 19.99 | 19.98 | 17.13 | 20.03 |
②Na2S2O3•5H2O在产品中的质量分数是90.2%(Na2S2O3•5H2O的式量为248,计算结果保留1位小数).
| 弱酸化学式 | CH3COOH | HCN | H2CO3 |
| 电离平衡常数(25℃) | 1.8×l0-5 | 4.9×l0-10 | K1=4.3×l0-7K2=5.6×l0-11 |
| A. | 向NaCN 溶液中通入少量CO2发生的离子反应为:2CN-+H2O+CO2═2HCN+CO32- | |
| B. | 等物质的量浓度的各溶液pH关系为:pH(NaCN)>pH(Na2CO3)>pH(CH3COONa) | |
| C. | a mol/LHCN溶液与b mol/LNaOH溶液等体积混合后,所得溶液中c(Na+)>c(CN-),则b一定大 于a | |
| D. | NaHCO3和Na2CO3的混合溶液中,一定存在:c(Na+)+c(H+)=c(OH-)+c(HCO3-)+2c(CO32-) |
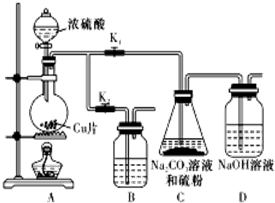
 次硫酸氢钠甲醛(NaHSO2•HCHO•2H2O)俗称吊白块,不稳定,120℃时会分解,在印染、医药以及原子能工业中有广泛应用.以Na2SO3、SO2、HCHO和锌粉为原料制备次硫酸氢钠甲醛的实验步骤如图:
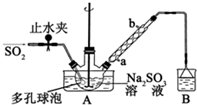
次硫酸氢钠甲醛(NaHSO2•HCHO•2H2O)俗称吊白块,不稳定,120℃时会分解,在印染、医药以及原子能工业中有广泛应用.以Na2SO3、SO2、HCHO和锌粉为原料制备次硫酸氢钠甲醛的实验步骤如图: 200mL某物质的量浓度的NaOH溶液中缓慢通入一定量的CO2,充分反应后,得到Na2CO3和NaHCO3的混合溶液.向上述所得溶液中,逐滴滴加2mol•L-1的盐酸,所得气体的体积与所加盐酸的体积关系如图所示:
200mL某物质的量浓度的NaOH溶液中缓慢通入一定量的CO2,充分反应后,得到Na2CO3和NaHCO3的混合溶液.向上述所得溶液中,逐滴滴加2mol•L-1的盐酸,所得气体的体积与所加盐酸的体积关系如图所示: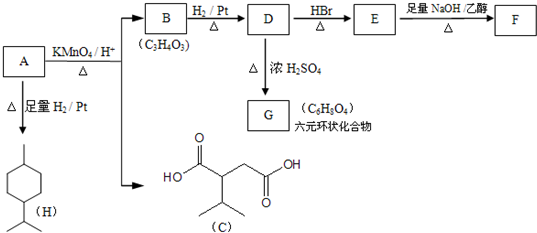
 .
. .
. .
.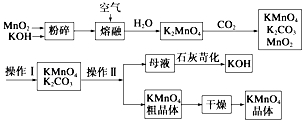 高锰酸钾可用于生活消毒,是中学化学常见的氧化剂.工业上,用软锰矿制高锰酸钾的流程如下:
高锰酸钾可用于生活消毒,是中学化学常见的氧化剂.工业上,用软锰矿制高锰酸钾的流程如下: