题目内容
10.下列变化中属于吸热反应的是( )①液态水汽化
②将胆矾加热变为白色粉末
③浓硫酸稀释
④KClO3分解制取O2
⑤生石灰与水反应生成熟石灰
⑥CaCO3高温分解
⑦CO2+C$\frac{\underline{\;高温\;}}{\;}$2CO
⑧Ba(OH)2•8H2O与固体NH4Cl混合
⑨C+H2O(g)$\frac{\underline{\;高温\;}}{\;}$CO+H2
⑩Al与盐酸反应.
| A. | ②④⑥⑦⑧⑨ | B. | ①②④⑥⑦⑧⑨ | C. | ①③④⑤⑥⑧⑩ | D. | ①②④⑧⑨ |
分析 常见的放热反应有:所有的物质燃烧、所有金属与酸反应、金属与水反应、所有中和反应、绝大多数化合反应和铝热反应;
常见的吸热反应有:绝大数分解反应(双氧水分解是放热反应)、个别的化合反应(如C和CO2)、置换以及某些复分解反应(如铵盐和强碱),以此解答该题.
解答 解:②将胆矾加热变为白色粉末、④KClO3分解制取O2、⑥CaCO3高温分解等属于分解反应,为吸热反应,而⑦CO2+C$\frac{\underline{\;高温\;}}{\;}$2CO、⑨C+H2O(g)$\frac{\underline{\;高温\;}}{\;}$CO+H2 等属于以C、氢气为还原剂的吸热反应;⑧Ba(OH)2•8H2O与固体NH4Cl混合,为吸热反应;
①液态水汽化、③浓硫酸稀释为物理变化,不是吸热反应,也不是放热反应;
⑤生石灰与水反应生成熟石灰、⑩Al与盐酸反应为放热反应.
故选A.
点评 本题考查化学反应与能量变化,为高频考点,侧重考查学生的分析能力,难度不大,抓住中学化学中常见的吸热或放热的反应是解题的关键.

练习册系列答案
 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案
相关题目
11.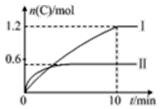 在2L的恒容密闭容器中充入A(g)和B(g),发生反应A(g)+B(g)?2C(g)+D(s)△H=a kJ•mol-1,实验内容和结果分别如表和图所示,下列说法正确的是( )
在2L的恒容密闭容器中充入A(g)和B(g),发生反应A(g)+B(g)?2C(g)+D(s)△H=a kJ•mol-1,实验内容和结果分别如表和图所示,下列说法正确的是( )
 在2L的恒容密闭容器中充入A(g)和B(g),发生反应A(g)+B(g)?2C(g)+D(s)△H=a kJ•mol-1,实验内容和结果分别如表和图所示,下列说法正确的是( )
在2L的恒容密闭容器中充入A(g)和B(g),发生反应A(g)+B(g)?2C(g)+D(s)△H=a kJ•mol-1,实验内容和结果分别如表和图所示,下列说法正确的是( )| 实验 序号 | 温度 | 起始物质的量 | 热量 变化 | |
| A | B | |||
| Ⅰ | 600℃ | 1 mol | 3 mol | 96 kJ |
| Ⅱ | 800℃ | 1.5 mol | 0.5 mol | -- |
| A. | 上述方程式中a=-160 | |
| B. | 实验Ⅰ中,10 min内平均速率v(B)=0.06 mol•L-1•min-1 | |
| C. | 600℃时,该反应的平衡常数是0.45 | |
| D. | 向实验Ⅱ的平衡体系中再充入0.5 mol A和1.5 mol B,A的转化率减小 |
12.草酸钴用途广泛,可用于指示剂和催化剂制备.一种利用水钴矿[主要成分为Co2O3,含少量Fe2O3、Al2O3、MnO、MgO、CaO等]制取CoC2O4•2H2O工艺流程如图1:
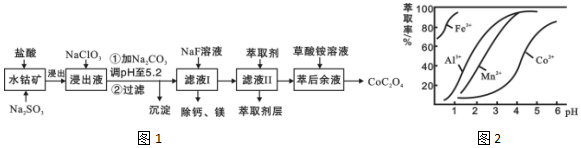
已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Ca2+、Mg2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见表:
(1)浸出过程中加入Na2SO3的目的是将Fe3+、Co3+还原(填离子符号).
(2)NaClO3的作用是将浸出液中的Fe2+氧化成Fe3+,产物中氯元素处于最低化合价.该反应的离子方程式为ClO3-+6Fe2++6H+=6Fe3++Cl-+3H2O.
(3)请用平衡移动原理分析加Na2CO3能使浸出液中Fe3+、Al3+转化成氢氧化物沉淀的原因是:R3++3H2O?R(OH)3+3H+,加入碳酸钠后,H+与CO32-反应,使水解平衡右移,从而产生沉淀.
(4)萃取剂对金属离子的萃取率与pH的关系如图2所示.
滤液Ⅱ中加入萃取剂的作用是除去溶液中的Mn2+;使用萃取剂适宜的pH是B.
A.接近2.0 B.接近3.0 C.接近4.0
(5)“除钙、镁”是将溶液中Ca2+与Mg2+转化为MgF2、CaF2沉淀.已知Ksp(MgF2)=7.35×10-11、Ksp(CaF2)=1.05×10-10.当加入过量NaF后,所得滤液$\frac{c(M{g}^{2+})}{c(C{a}^{2+})}$=0.7.
(6)为测定制得的无水草酸钴样品的纯度,现称取样品mg,先用适当试剂将其转化,得到纯净的草酸铵溶液,再用过量的稀硫酸酸化,用cmol/L高锰酸钾溶液去滴定,当溶液由无色变为浅紫色(或紫红色)(填颜色变化),共用去高锰酸钾溶液VmL(CoC2O4的摩尔质量147g/mol),计算草酸钴样品的纯度为$\frac{36.75cV}{m}$%.

已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Ca2+、Mg2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见表:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 完全沉淀的pH | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
(2)NaClO3的作用是将浸出液中的Fe2+氧化成Fe3+,产物中氯元素处于最低化合价.该反应的离子方程式为ClO3-+6Fe2++6H+=6Fe3++Cl-+3H2O.
(3)请用平衡移动原理分析加Na2CO3能使浸出液中Fe3+、Al3+转化成氢氧化物沉淀的原因是:R3++3H2O?R(OH)3+3H+,加入碳酸钠后,H+与CO32-反应,使水解平衡右移,从而产生沉淀.
(4)萃取剂对金属离子的萃取率与pH的关系如图2所示.
滤液Ⅱ中加入萃取剂的作用是除去溶液中的Mn2+;使用萃取剂适宜的pH是B.
A.接近2.0 B.接近3.0 C.接近4.0
(5)“除钙、镁”是将溶液中Ca2+与Mg2+转化为MgF2、CaF2沉淀.已知Ksp(MgF2)=7.35×10-11、Ksp(CaF2)=1.05×10-10.当加入过量NaF后,所得滤液$\frac{c(M{g}^{2+})}{c(C{a}^{2+})}$=0.7.
(6)为测定制得的无水草酸钴样品的纯度,现称取样品mg,先用适当试剂将其转化,得到纯净的草酸铵溶液,再用过量的稀硫酸酸化,用cmol/L高锰酸钾溶液去滴定,当溶液由无色变为浅紫色(或紫红色)(填颜色变化),共用去高锰酸钾溶液VmL(CoC2O4的摩尔质量147g/mol),计算草酸钴样品的纯度为$\frac{36.75cV}{m}$%.
9.某化学式为C5H12O的有机物,既能跟Na反应,又能在Cu催化下与O2反应,则满足该条件的化合物有( )
| A. | 5种 | B. | 6种 | C. | 7种 | D. | 8种 |
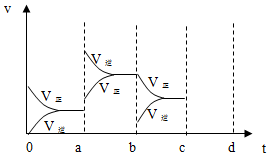
5. 向50mL稀H2SO4与稀HNO3的混合溶液中逐渐加入铁粉,假设加入铁粉的质量与产生气体的体积(标准状况)之间的关系如图所示,且每一段只对应一个反应.下列说法正确的是( )
向50mL稀H2SO4与稀HNO3的混合溶液中逐渐加入铁粉,假设加入铁粉的质量与产生气体的体积(标准状况)之间的关系如图所示,且每一段只对应一个反应.下列说法正确的是( )
 向50mL稀H2SO4与稀HNO3的混合溶液中逐渐加入铁粉,假设加入铁粉的质量与产生气体的体积(标准状况)之间的关系如图所示,且每一段只对应一个反应.下列说法正确的是( )
向50mL稀H2SO4与稀HNO3的混合溶液中逐渐加入铁粉,假设加入铁粉的质量与产生气体的体积(标准状况)之间的关系如图所示,且每一段只对应一个反应.下列说法正确的是( )| A. | 开始时产生的气体为H2 | |
| B. | AB段发生的反应为置换反应 | |
| C. | 所用混合溶液中c(HNO3)=0.5 mol•L-1 | |
| D. | 参加反应铁粉的总质量m2=5.6 g |
20.下列各组有机物,无论它们以何种物质的量的比例混和,只要总物质的量一定,则在完全燃烧时,消耗氧气的量为一定值的是( )
| A. | C2H6和C3H8 | B. | C5H10和C6H6 | C. | C2H6O和C2H4O2 | D. | C3H6和C3H8O2 |
 二甲醚是一种重要的清洁燃料,也可替代氟利昂作制冷剂等,对臭氧层无破坏作用.工业上可利用煤的气化产物(水煤气)合成二甲醚.
二甲醚是一种重要的清洁燃料,也可替代氟利昂作制冷剂等,对臭氧层无破坏作用.工业上可利用煤的气化产物(水煤气)合成二甲醚.