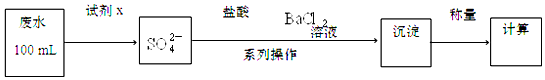
题目内容
12.草酸钴用途广泛,可用于指示剂和催化剂制备.一种利用水钴矿[主要成分为Co2O3,含少量Fe2O3、Al2O3、MnO、MgO、CaO等]制取CoC2O4•2H2O工艺流程如图1: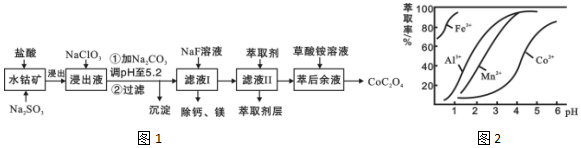
已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Ca2+、Mg2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见表:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 完全沉淀的pH | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
(2)NaClO3的作用是将浸出液中的Fe2+氧化成Fe3+,产物中氯元素处于最低化合价.该反应的离子方程式为ClO3-+6Fe2++6H+=6Fe3++Cl-+3H2O.
(3)请用平衡移动原理分析加Na2CO3能使浸出液中Fe3+、Al3+转化成氢氧化物沉淀的原因是:R3++3H2O?R(OH)3+3H+,加入碳酸钠后,H+与CO32-反应,使水解平衡右移,从而产生沉淀.
(4)萃取剂对金属离子的萃取率与pH的关系如图2所示.
滤液Ⅱ中加入萃取剂的作用是除去溶液中的Mn2+;使用萃取剂适宜的pH是B.
A.接近2.0 B.接近3.0 C.接近4.0
(5)“除钙、镁”是将溶液中Ca2+与Mg2+转化为MgF2、CaF2沉淀.已知Ksp(MgF2)=7.35×10-11、Ksp(CaF2)=1.05×10-10.当加入过量NaF后,所得滤液$\frac{c(M{g}^{2+})}{c(C{a}^{2+})}$=0.7.
(6)为测定制得的无水草酸钴样品的纯度,现称取样品mg,先用适当试剂将其转化,得到纯净的草酸铵溶液,再用过量的稀硫酸酸化,用cmol/L高锰酸钾溶液去滴定,当溶液由无色变为浅紫色(或紫红色)(填颜色变化),共用去高锰酸钾溶液VmL(CoC2O4的摩尔质量147g/mol),计算草酸钴样品的纯度为$\frac{36.75cV}{m}$%.
分析 含钴废料中加入盐酸和亚硫酸钠,可得CoCl2、AlCl3、FeCl2、MgCl2、CaCl2、MnCl2,加入NaClO3,可得到FeCl3,然后加入Na2CO3调pH至5.2,可得到Fe(OH)3、Al(OH)3沉淀,过滤后所得滤液主要含有CoCl2、MgCl2、CaCl2、MnCl2,向溶液中加入NaF溶液,除去钙镁离子,然后过滤得到的滤液中II中加入萃取剂,萃取后溶液加入草酸铵,得到草酸钴,
(1)亚硫酸钠具有还原性,能还原氧化性离子;
(2)NaClO3具有氧化性,能将浸出液中的Fe2+氧化成Fe3+,自身被还原生成氯离子,同时生成水;
(3)Fe3+、Al3+水解导致溶液呈酸性,碳酸根离子和氢离子反应,从而促进水解平衡向右移动;
(4)滤液Ⅱ中加入萃取剂的作用是除去锰离子;根据图知,调节溶液PH在3.0~3.5之间,可使Mn2+完全沉淀,并防止Co2+转化为Co(OH)2沉淀;
(5)由溶度积可知,滤液Ⅰ“除钙、镁”是将溶液中Ca2+与Mg2+转化为氟化钙、氟化镁沉淀,根据溶度积可知c(Mg2+):c(Ca2+)=$\frac{Ksp(Mg{F}_{2})}{Ksp(Ca{F}_{2})}$;
(6)用高锰酸钾溶液去滴定,当溶液由无色变为浅紫色(或紫红色),且半分钟内不变色时,达到滴定终点;根据n=cV计算反应中草酸的物质的量,根据方程式5H2C2O4+2MnO4-+6H+=2Mn2++10CO2↑+8H2O计算V中高锰酸钾的物质的量,再计算原样品中的物质的量,进而计算纯度.
解答 解:(1)亚硫酸钠具有还原性,能还原氧化性离子Fe3+、Co3+,所以浸出过程中加入Na2SO3的目的是将Fe3+、Co3+还原;
故答案为:Fe3+、Co3+;
(2)NaClO3具有氧化性,能将浸出液中的Fe2+氧化成Fe3+,自身被还原生成氯离子,同时生成水,离子反应方程式为ClO3-+6Fe2++6H+=6Fe3++Cl-+3H2O;
故答案为:ClO3-+6Fe2++6H+=6Fe3++Cl-+3H2O;
(3)Fe3+、Al3+水解导致溶液呈酸性,水解方程式为R3++3H2O?R(OH)3+3H+,碳酸根离子和氢离子反应,从而促进水解平衡向右移动,产生氢氧化铁、氢氧化铝沉淀;
故答案为:R3++3H2O?R(OH)3+3H+,加入碳酸钠后,H+与CO32-反应,使水解平衡右移,从而产生沉淀;
(4)根据流程图可知,此时溶液中存在Mn2+、Co2+金属离子;
由萃取剂对金属离子的萃取率与pH的关系可知,调节溶液PH在3.0~3.5之间,可使Mn2+完全沉淀,并防止Co2+转化为Co(OH)2沉淀;
故答案为:除去溶液中的Mn2+;B;
(5)由溶度积可知,滤液Ⅰ“除钙、镁”是将溶液中Ca2+与Mg2+转化为CaF2、MgF2沉淀,根据溶度积可知c(Mg2+):c(Ca2+)=$\frac{Ksp(Mg{F}_{2})}{Ksp(Ca{F}_{2})}$=$\frac{7.35×1{0}^{-11}}{1.05×1{0}^{-10}}$=0.7;
故答案为:0.7;
(6)用高锰酸钾溶液去滴定,当溶液由无色变为浅紫色(或紫红色),且半分钟内不变色时,达到滴定终点;根据n=cV计算反应中草酸的物质的量,设样品中含CoC2O4质量为x,根据方程式:5H2C2O4+2MnO4-+6H+=2Mn2++10CO2↑+8H2O,草酸根守恒可得:
5CoC2O4-5(NH4)2C2O4-5H2C2O4-2MnO4-
146.93g 2mol
x CV×10-3mol
样品纯度=$\frac{x}{m}$×100%,带入数据可得纯度为$\frac{36.75cV}{m}$%;
故答案为:无色变为浅紫色(或紫红色);$\frac{36.75cV}{m}$%.
点评 本题考查物质分离和提纯,为高频考点,涉及溶度积常数计算、沉淀与pH的关系、盐类水解、氧化还原反应等知识点,明确实验原理是解本题关键,知道涉及的操作方法及发生的反应,难点是溶度积常数计算,题目难度中等.

| A. | 胶体区别于其他分散系的本质特征是分散质的微粒直径在10-5:10-7m之间 | |
| B. | 光线透过胶体时,胶体中可发生丁达尔效应 | |
| C. | Fe(OH)3胶体能够使水中悬浮的固体颗粒沉降,达到净水目的 | |
| D. | 用平行光照射NaCl溶液和Fe(OH)3胶体时,产生的现象相同 |
①质量相同
②碳原子数和氮原子数相等
③所含分子数相等
④所含质子总数相等.
| A. | ①②③ | B. | ②③④ | C. | ①②④ | D. | ①③④ |
| A. | 常温常压下,23gNO2和N2O4混合气体中含O原子数为NA | |
| B. | 1mol/L Al2(SO4)3溶液中含SO42-个数为3NA,含Al3+个数小于2NA | |
| C. | 在标准状况下,将22.4L SO3溶于水配成1L溶液,所得溶液中含SO42-个数为NA | |
| D. | 将1moL 氯气通入到足量水中,则N(HClO)+N(Cl-)+N(ClO-)═2NA |
| A. | 体积数据 | B. | 体积分数 | C. | 质量分数 | D. | 物质的量浓度 |
①液态水汽化
②将胆矾加热变为白色粉末
③浓硫酸稀释
④KClO3分解制取O2
⑤生石灰与水反应生成熟石灰
⑥CaCO3高温分解
⑦CO2+C$\frac{\underline{\;高温\;}}{\;}$2CO
⑧Ba(OH)2•8H2O与固体NH4Cl混合
⑨C+H2O(g)$\frac{\underline{\;高温\;}}{\;}$CO+H2
⑩Al与盐酸反应.
| A. | ②④⑥⑦⑧⑨ | B. | ①②④⑥⑦⑧⑨ | C. | ①③④⑤⑥⑧⑩ | D. | ①②④⑧⑨ |
(1)Ti(BH4)2是一种过渡元素硼氢化物储氢材料.
①基态Ti2+中含有的电子数为20,电子占据的最高能级是3d,该能级具有的原子轨道数为5.
②BH4-中的B原子的杂化方式是sp3.
(2)金属氢化物是具有良好发展前景的储氢材料.
①LiH中,离子半径:Li+<(填“>”“<”或“=”)H-.
②某储氢材料是短周期金属元素M的氢化物,M的部分电离能如表所示:
| I1/kJ•mol-1 | I2/kJ•mol-1 | I3/kJ•mol-1 | I4/kJ•mol-1 | I5/kJ•mol-1 |
| 738 | 1451 | 7733 | 10540 | 13630 |
(3)液氨是富氢物质,是氢能的理想载体.
①NH3的相对分子质量小于PH3,但NH3的沸点却远高于PH3,其原因是氨气分子之间可以形成氢键.
②NH3容易和分子中有空轨道的BF3反应形成新的化合物(用“→”表示配位键),该化合物的结构式为
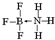 .
.(4)2008年,Yoon等人发现Ca与C60(分子结构如图甲)生成的Ca32C60能大量吸附H2分子.
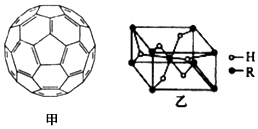
①C60晶体易溶于苯、CS2,C60是非极性(填“极性”或“非极性”)分子.
②1mol C60分子中,含有σ 键数目为90NA个.(阿伏加德罗常数数值为NA)
(5)某金属氢化物储氢材料的晶胞结构如图乙所示,该金属氢化物的化学式为H2R.已知该晶体的密度为a g•cm-3,金属元素R的相对原子质量为M,阿伏加德罗常数数值为NA,则该晶胞的体积为$\frac{2M+4}{{a{N_A}}}$cm3.