题目内容
19.一定质量的氧化铁、氧化铜和铁粉混合物放入100mL6.0mol•L-1盐酸中,充分反应后产生896mLH2(标准状况),残留固体1.28g.过滤,滤液中无Cu2+.将滤液加水稀释到400mL.测得其中c(H+)为0.6mol•L-1.(1)滤液中铁元素的化合价是+2
(2)残留固体的成分是Cu
(3)反应过程中消耗HCl的物质的量是0.36mol
(4)原混合物中氧化铁的物质的量是多少?(请写出计算过程)
分析 反应后溶液中还有较多H+离子剩余,且滤液中没有Cu2+,可知残留物没有Fe,只有Cu,而Cu残留可以说明溶液中没有Fe3+,溶液中阳离子为H+和Fe2+,溶质为FeCl2和HCl.
解答 解:反应后溶液中还有较多H+离子剩余,且滤液中没有Cu2+,可知残留物没有Fe,只有Cu,而Cu残留可以说明溶液中没有Fe3+,溶液中阳离子为H+和Fe2+,溶质为FeCl2和HCl,
(1)由以上分析得,铁元素的化合价是+2价,故答案为:+2;
(2)由以上分析得,残留固体的成分是Cu,故答案为:Cu;
(3)反应后剩余n(H+)=0.6mol/L×0.4L=0.24mol,原溶液中n(HCl)=6.0mol/L×0.1L=0.6mol,故消耗盐酸的物质的量为n剩(HCl)=0.6mol-0.24mol=0.36mol,故答案为:0.36mol;
(4)参加反应的HCl中的H元素转化到氢气、水中,根据H原子守恒,2n(H2O)+2n(H2)=n总(HCl)-n余(H+),即2n(H2O)+2×$\frac{0.896L}{22.4L/mol}$=0.36mol,n(H2O)=0.14mol,故混合物中n(O)=n(H2O)=0.14mol,
由铜元素守恒,则n(CuO)=n(Cu)=$\frac{1.28g}{64g/mol}$=0.02mol,
由O原子守恒:3n(Fe2O3)+n(CuO)=0.14mol,则n(Fe2O3)=0.04mol,
答:原混合物中氧化铁的物质的量是0.04mol.
点评 本题考查混合物计算,为高频考点,侧重于学生的分析能力和计算能力的考查,注意从溶液存在的离子判断物质反应的程度,注意利用守恒的方法计算,题目难度中等.

练习册系列答案
相关题目
20.关于同温、同压下等体积的N2O和CO2的叙述正确的是( )
①质量相同
②碳原子数和氮原子数相等
③所含分子数相等
④所含质子总数相等.
①质量相同
②碳原子数和氮原子数相等
③所含分子数相等
④所含质子总数相等.
| A. | ①②③ | B. | ②③④ | C. | ①②④ | D. | ①③④ |
10.下列变化中属于吸热反应的是( )
①液态水汽化
②将胆矾加热变为白色粉末
③浓硫酸稀释
④KClO3分解制取O2
⑤生石灰与水反应生成熟石灰
⑥CaCO3高温分解
⑦CO2+C$\frac{\underline{\;高温\;}}{\;}$2CO
⑧Ba(OH)2•8H2O与固体NH4Cl混合
⑨C+H2O(g)$\frac{\underline{\;高温\;}}{\;}$CO+H2
⑩Al与盐酸反应.
①液态水汽化
②将胆矾加热变为白色粉末
③浓硫酸稀释
④KClO3分解制取O2
⑤生石灰与水反应生成熟石灰
⑥CaCO3高温分解
⑦CO2+C$\frac{\underline{\;高温\;}}{\;}$2CO
⑧Ba(OH)2•8H2O与固体NH4Cl混合
⑨C+H2O(g)$\frac{\underline{\;高温\;}}{\;}$CO+H2
⑩Al与盐酸反应.
| A. | ②④⑥⑦⑧⑨ | B. | ①②④⑥⑦⑧⑨ | C. | ①③④⑤⑥⑧⑩ | D. | ①②④⑧⑨ |
14.下列有关说法正确的是( )
| A. | 化学平衡向正向移动,反应物浓度一定降低 | |
| B. | 化学平衡向正向移动,生成物的浓度一定增加 | |
| C. | 化学平衡向正向移动,反应物的转化率一定增大 | |
| D. | 化学平衡向正向移动时,正反应速率一定大于逆反应速率 |
4.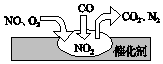 随着我国汽车年销量的大幅增加,空气环境受到了很大的污染.汽车尾气装置里,气体在催化剂表面吸附与解吸作用的过程如图所示,下列说法正确的是( )
随着我国汽车年销量的大幅增加,空气环境受到了很大的污染.汽车尾气装置里,气体在催化剂表面吸附与解吸作用的过程如图所示,下列说法正确的是( )
 随着我国汽车年销量的大幅增加,空气环境受到了很大的污染.汽车尾气装置里,气体在催化剂表面吸附与解吸作用的过程如图所示,下列说法正确的是( )
随着我国汽车年销量的大幅增加,空气环境受到了很大的污染.汽车尾气装置里,气体在催化剂表面吸附与解吸作用的过程如图所示,下列说法正确的是( )| A. | 反应中NO为氧化剂,N2为氧化产物 | |
| B. | 汽车尾气的主要污染成分包括CO、NO和N2 | |
| C. | NO和O2必须在催化剂表面才能反应 | |
| D. | 催化转化总化学方程式为2NO+O2+4CO=4CO2+N2 |
11.氢能的存储是氢能应用的主要瓶颈,开发新型储氢材料是氢能利用的重要研究方向,目前所采用或正在研究的主要储氢材料有:配位氢化物、富氢载体化合物、碳质材料、金属氢化物等.
(1)Ti(BH4)2是一种过渡元素硼氢化物储氢材料.
①基态Ti2+中含有的电子数为20,电子占据的最高能级是3d,该能级具有的原子轨道数为5.
②BH4-中的B原子的杂化方式是sp3.
(2)金属氢化物是具有良好发展前景的储氢材料.
①LiH中,离子半径:Li+<(填“>”“<”或“=”)H-.
②某储氢材料是短周期金属元素M的氢化物,M的部分电离能如表所示:
该氢化物的化学式为MgH2.
(3)液氨是富氢物质,是氢能的理想载体.
①NH3的相对分子质量小于PH3,但NH3的沸点却远高于PH3,其原因是氨气分子之间可以形成氢键.
②NH3容易和分子中有空轨道的BF3反应形成新的化合物(用“→”表示配位键),该化合物的结构式为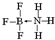 .
.
(4)2008年,Yoon等人发现Ca与C60(分子结构如图甲)生成的Ca32C60能大量吸附H2分子.
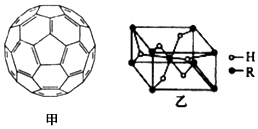
①C60晶体易溶于苯、CS2,C60是非极性(填“极性”或“非极性”)分子.
②1mol C60分子中,含有σ 键数目为90NA个.(阿伏加德罗常数数值为NA)
(5)某金属氢化物储氢材料的晶胞结构如图乙所示,该金属氢化物的化学式为H2R.已知该晶体的密度为a g•cm-3,金属元素R的相对原子质量为M,阿伏加德罗常数数值为NA,则该晶胞的体积为$\frac{2M+4}{{a{N_A}}}$cm3.
(1)Ti(BH4)2是一种过渡元素硼氢化物储氢材料.
①基态Ti2+中含有的电子数为20,电子占据的最高能级是3d,该能级具有的原子轨道数为5.
②BH4-中的B原子的杂化方式是sp3.
(2)金属氢化物是具有良好发展前景的储氢材料.
①LiH中,离子半径:Li+<(填“>”“<”或“=”)H-.
②某储氢材料是短周期金属元素M的氢化物,M的部分电离能如表所示:
| I1/kJ•mol-1 | I2/kJ•mol-1 | I3/kJ•mol-1 | I4/kJ•mol-1 | I5/kJ•mol-1 |
| 738 | 1451 | 7733 | 10540 | 13630 |
(3)液氨是富氢物质,是氢能的理想载体.
①NH3的相对分子质量小于PH3,但NH3的沸点却远高于PH3,其原因是氨气分子之间可以形成氢键.
②NH3容易和分子中有空轨道的BF3反应形成新的化合物(用“→”表示配位键),该化合物的结构式为
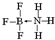 .
.(4)2008年,Yoon等人发现Ca与C60(分子结构如图甲)生成的Ca32C60能大量吸附H2分子.

①C60晶体易溶于苯、CS2,C60是非极性(填“极性”或“非极性”)分子.
②1mol C60分子中,含有σ 键数目为90NA个.(阿伏加德罗常数数值为NA)
(5)某金属氢化物储氢材料的晶胞结构如图乙所示,该金属氢化物的化学式为H2R.已知该晶体的密度为a g•cm-3,金属元素R的相对原子质量为M,阿伏加德罗常数数值为NA,则该晶胞的体积为$\frac{2M+4}{{a{N_A}}}$cm3.
9.以下是一些分子的比例模型,其中空间结构和原子大小比例错误的是( )
| A. |  NH3 NH3 | B. |  H2O H2O | C. |  HCl HCl | D. |  CCl4 CCl4 |
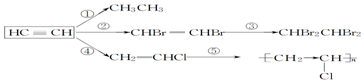
 ,加聚反应.
,加聚反应.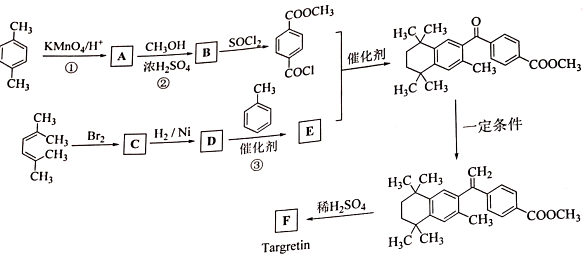
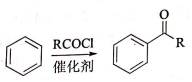 ②
②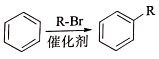
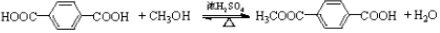 .
.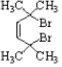 .
.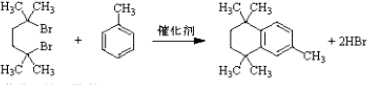 .
.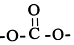 结构)
结构)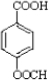 ,
,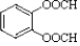 .
.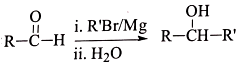 R-CH-R′(R、R′为烃基)
R-CH-R′(R、R′为烃基)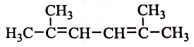 ,写出合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件).
,写出合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件).