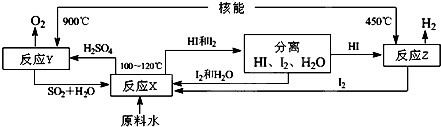
题目内容
铁和铝是我们日常生活中应用最广泛的金属材料.
(1)已知:2Fe(s)+
O2(g)═Fe2O3(s)△H=-823.7kJ?mol-1
2Al(s)+
O2(g)═Al2O3(s)△H=-1675.7kJ?mol-1
写出铝热反应的热化学方程式 ,该反应常用于 ,理由是 .
(2)工业上用Al-Si-Fe合金在一定条件下还原白云石[主要成分为CaMg(CO3)2]可制取金属镁.实际生产中镁的还原率在不同条件下的变化曲线如图1、图2所示.
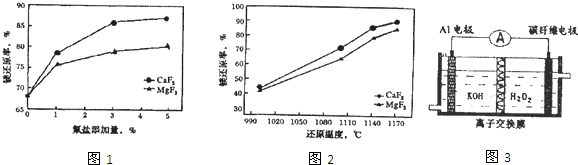
①实际生产中通过添加氟盐来提高镁的还原率,选择最佳的氟盐及添加量是 .
②温度一般控制在1140℃,原因是 .
③若将一定质量的Al-Si-Fe合金投入100mL a mol/L硫酸(过量),充分反应后过滤,向滤液中加入5mol/L的氢氧化钠溶液,当加到200mL时生成的沉淀量最大,则a的值为 .
(3)大功率Al-H2O2动力电池原理如图3所示,电池放电时负极的Al转化为Al(OH)4-.透过离子交换膜的离子为 ,该电池反应的离子方程式为 .
(1)已知:2Fe(s)+
| 3 |
| 2 |
2Al(s)+
| 3 |
| 2 |
写出铝热反应的热化学方程式
(2)工业上用Al-Si-Fe合金在一定条件下还原白云石[主要成分为CaMg(CO3)2]可制取金属镁.实际生产中镁的还原率在不同条件下的变化曲线如图1、图2所示.

①实际生产中通过添加氟盐来提高镁的还原率,选择最佳的氟盐及添加量是
②温度一般控制在1140℃,原因是
③若将一定质量的Al-Si-Fe合金投入100mL a mol/L硫酸(过量),充分反应后过滤,向滤液中加入5mol/L的氢氧化钠溶液,当加到200mL时生成的沉淀量最大,则a的值为
(3)大功率Al-H2O2动力电池原理如图3所示,电池放电时负极的Al转化为Al(OH)4-.透过离子交换膜的离子为
考点:用盖斯定律进行有关反应热的计算,化学电源新型电池,镁、铝的重要化合物
专题:化学反应中的能量变化,电化学专题,几种重要的金属及其化合物
分析:(1)根据盖斯定律来分析,铝热反应常用于焊接钢轨;
(2)①根据图象分析;
②该温度时,镁的还原率已很高;
③根据生成的沉淀量最大时,溶质为硫酸钠,利用Na原子守恒求算;
(3)负极反应是要消耗OH-,所以OH-要透过离子交换膜到负极区域;根据正负极的反应物书写.
(2)①根据图象分析;
②该温度时,镁的还原率已很高;
③根据生成的沉淀量最大时,溶质为硫酸钠,利用Na原子守恒求算;
(3)负极反应是要消耗OH-,所以OH-要透过离子交换膜到负极区域;根据正负极的反应物书写.
解答:
解:(1)已知反应①2Fe(s)+
O2(g)═Fe2O3(s)△H=-823.7kJ?mol-1
②2Al(s)+
O2(g)═Al2O3(s)△H=-1675.7kJ?mol-1
根据盖斯定律,将②-①可得:2Al(s)+Fe2O3(s)═Al2O3(s)+2Fe(s)△H=(-1675.7kJ?mol-1)-(-823.7kJ?mol-1)=-852.0kJ?mol-1,
铝热反应常用于焊接铁轨,原因是反应放出大量的热使生成的铁熔化,
故答案为:2Al(s)+Fe2O3(s)═Al2O3(s)+2Fe(s)△H=-852.0kJ?mol-1,焊接铁轨,反应放出大量的热使生成的铁熔化;
(2)①根据图象分析加入CaF2时镁的还原率高,当加入的CaF2的量为3%时,镁的还原率已经很高,再增加CaF2的量,镁的还原率变化很小,故答案为:CaF2、3%;
②根据图象可知,该温度时,镁的还原率已近90%,温度低还原率低,温度太高能耗高,
故答案为:该温度时,镁的还原率已近90%,温度低还原率低,温度太高能耗高;
③根据生成的沉淀量最大时,溶质为硫酸钠,利用Na原子守恒:Na2SO 4 ~2NaOH
0.1L×amol/L 0.2L×5mol/L
所以,a=5mol/L,
故答案为:5;
(3)负极反应是要消耗OH-,OH-要透过离子交换膜到负极区域,电池反应为:2Al+3H2O2+2OH-═2Al(OH)3,故答案为:OH-;2Al+3H2O2+2OH-═2Al(OH)4-.
| 3 |
| 2 |
②2Al(s)+
| 3 |
| 2 |
根据盖斯定律,将②-①可得:2Al(s)+Fe2O3(s)═Al2O3(s)+2Fe(s)△H=(-1675.7kJ?mol-1)-(-823.7kJ?mol-1)=-852.0kJ?mol-1,
铝热反应常用于焊接铁轨,原因是反应放出大量的热使生成的铁熔化,
故答案为:2Al(s)+Fe2O3(s)═Al2O3(s)+2Fe(s)△H=-852.0kJ?mol-1,焊接铁轨,反应放出大量的热使生成的铁熔化;
(2)①根据图象分析加入CaF2时镁的还原率高,当加入的CaF2的量为3%时,镁的还原率已经很高,再增加CaF2的量,镁的还原率变化很小,故答案为:CaF2、3%;
②根据图象可知,该温度时,镁的还原率已近90%,温度低还原率低,温度太高能耗高,
故答案为:该温度时,镁的还原率已近90%,温度低还原率低,温度太高能耗高;
③根据生成的沉淀量最大时,溶质为硫酸钠,利用Na原子守恒:Na2SO 4 ~2NaOH
0.1L×amol/L 0.2L×5mol/L
所以,a=5mol/L,
故答案为:5;
(3)负极反应是要消耗OH-,OH-要透过离子交换膜到负极区域,电池反应为:2Al+3H2O2+2OH-═2Al(OH)3,故答案为:OH-;2Al+3H2O2+2OH-═2Al(OH)4-.
点评:本题考查了盖斯定律,图象的分析,原子守恒,原电池原理的应用,题目比较综合,注重对学生综合能力的考查.

练习册系列答案
相关题目