题目内容
开源节流是应对能源危机的重要举措.
(1)H2的燃烧热为285.8kJ/mol,CO的燃烧热为282.8kJ/mol.现有5.6L(标况)的H2和CH4的混合气体,完全燃烧后,共放出71.15kJ的热量,并生成液态水,则混合气体中H2与CO的物质的量比为 .
(2)利用MnFe2O4可通过两步反应分解水制H2,第一步为:MnFe2O4
MnFe2O4-x+
O2,则第二步反应为 (不用写反应条件).
(3)如图是以SO2、I2、H2O为原料,利用核能使水分解制氢气的一种流程.
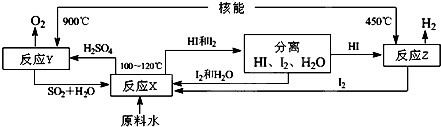
反应X的化学方程式为 ,该流程中循环使用的原料有 .
(1)H2的燃烧热为285.8kJ/mol,CO的燃烧热为282.8kJ/mol.现有5.6L(标况)的H2和CH4的混合气体,完全燃烧后,共放出71.15kJ的热量,并生成液态水,则混合气体中H2与CO的物质的量比为
(2)利用MnFe2O4可通过两步反应分解水制H2,第一步为:MnFe2O4
| ||
| x |
| 2 |
(3)如图是以SO2、I2、H2O为原料,利用核能使水分解制氢气的一种流程.

反应X的化学方程式为
考点:有关反应热的计算,常见的能量转化形式
专题:化学反应中的能量变化
分析:(1)依据氢气和一氧化碳燃烧热的热化学方程式列方程分析计算判断;
(2)第二步MnFe2O4-X和水反应生成MnFe2O4和氢气;
(3)在100-120℃条件下,碘、二氧化硫和水反应生成硫酸和氢碘酸;根据流程图判断能循环使用的物质.
(2)第二步MnFe2O4-X和水反应生成MnFe2O4和氢气;
(3)在100-120℃条件下,碘、二氧化硫和水反应生成硫酸和氢碘酸;根据流程图判断能循环使用的物质.
解答:
解:(1)H2和CO组成的混合气体5.6L(标况)物质的量为0.25mol,经充分燃烧后,放出总热量为71.15kJ,并生成液态水,依据氢气和一氧化碳燃烧热的热化学方程式计算,设氢气物质的量为x,一氧化碳物质的量为y,则x+y=0.25,285.8x+282.8y=71.15,计算得到x=1,y=1.5,混合气体中H2与CO的物质的量之比为:1:1.5=2:3,
(2)第二步MnFe2O4-X和水反应生成MnFe2O4和氢气,反应方程式为MnFe2O4-X+xH20=MnFe2O4+xH2↑.
故答案为:MnFe2O4-x+xH2O=MnFe2O4+xH2↑.
(3)在100-120℃条件下,碘、二氧化硫和水反应生成硫酸和氢碘酸,反应方程式为SO2+I2+2H2O=2HI+H2SO4,根据流程图知,该流程中循环使用的原料有SO2、I2;SO2+I2+H2O=2HI+H2SO4,SO2和I2.
(2)第二步MnFe2O4-X和水反应生成MnFe2O4和氢气,反应方程式为MnFe2O4-X+xH20=MnFe2O4+xH2↑.
故答案为:MnFe2O4-x+xH2O=MnFe2O4+xH2↑.
(3)在100-120℃条件下,碘、二氧化硫和水反应生成硫酸和氢碘酸,反应方程式为SO2+I2+2H2O=2HI+H2SO4,根据流程图知,该流程中循环使用的原料有SO2、I2;SO2+I2+H2O=2HI+H2SO4,SO2和I2.
点评:本题考查了化学反应方程式的书写等知识点,难度不大,会分析流程图是解本题的关键.

练习册系列答案
相关题目
已知H-H键键能(断裂时吸收或生成时释放的能量)为250kJ?mol-1,H-N键能为280kJ?mol-1,化学方程式:N2(g)+3H2(g)=2NH3(g);△H=-120.0kJ?mol-1.则N≡N键的键能是( )
| A、431kJ?mol-1 |
| B、946kJ?mol-1 |
| C、649kJ?mol-1 |
| D、810kJ?mol-1 |
