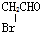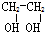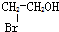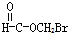题目内容
1.下列各组顺序,正确的是( )| A. | 微粒半径大小:S2->Cl->Na+>Al3+>F- | |
| B. | 热稳定性大小:SiH4>PH3>NH3 | |
| C. | 相同条件下与水反应的剧烈程度:Rb>K>Na>Li | |
| D. | 酸性强弱顺序:HClO4<H2SO4<H3PO4<H2SiO3 |
分析 A.电子层结构相同,核电荷数越大,离子半径越小;电子层数越大,半径越大;
B.元素的非金属性越强,对应的氢化物越稳定;
C.元素的金属性质越强,对应的单质与水反应越剧烈;
D.元素的非金属性越强,对应的最高价氧化物的水化物的酸性越强.
解答 解:A.电子层结构相同,核电荷数越大,离子半径越小,则半径S2->Cl-,F->Na+>Al3+,电子层数越大,半径越大,所以微粒半径:S2->Cl->F->Na+>Al3+,故A错误;
B.非金属性N>P>Si,元素的非金属性越强,对应的氢化物越稳定,故B错误;
C.同主族元素从上到下金属性逐渐增大,元素的金属性质越强,对应的单质与水反应越剧烈,故C正确;
D.非金属性Cl>S>P>Si,元素的非金属性越强,对应的最高价氧化物的水化物的酸性越强,故D错误.
故选C.
点评 本题考查元素周期律的递变规律,为高考常见题型,侧重于学生的分析能力的考查,题目难度中等,注意元素的金属性、非金属性与元素对应的单质、化合物的性质关系.

练习册系列答案
相关题目
12.下列关于物质性质变化的比较,不正确的是( )
| A. | 酸性强弱:HClO4>H3PO4>H2SO4 | B. | 原子半径大小:Na>P>N | ||
| C. | 碱性强弱:NaOH>Mg(OH)2>Al(OH)3 | D. | 金属性强弱:K>Na>Li |
9.在溶液中有Fe3+存在时,则可与它同时大量存在的微粒是( )
| A. | OH- | B. | Fe | C. | H+ | D. | SCN- |
16.向下列物质的溶液中通入CO2,不发生反应的是( )
| A. | Na2CO3 | B. | NaOH | C. | Na2SiO3 | D. | CaCl2 |
13.下列关于氧化还原反应的叙述中正确的是( )
| A. | 失去电子的反应为还原反应 | |
| B. | 含有氧元素的物质是氧化剂 | |
| C. | 氧化剂得到电子的数目和还原剂失去的电子的数目一定相等 | |
| D. | 氧化剂和还原剂不可能是同一种物质 |
10.化学与社会、生产、生活密切相关.下列说法正确的是( )
| A. | 为了增加食物的营养成分,可以大量使用食品添加剂 | |
| B. | 加碘盐是食盐中加入碘单质 | |
| C. | 石英可用于生产光导纤维 | |
| D. | 从海水中提取物质都必须通过化学反应才能实现 |
 .
. .
.