题目内容
11.一定量的铁粉和过量的3mol•L-1硫酸反应,当向其中加入少量的下物质:①铁片 ②铜粉 ③浓硫酸 ④石墨 ⑤二氧化锰 ⑥饱和食盐水 ⑦CuSO4 ⑧NaNO3晶体时,能够加快反应速率,又不影响产生H2总量的是( )| A. | ①③⑧ | B. | ②③④ | C. | ①④⑥ | D. | ④⑤⑦ |
分析 硫酸过量、铁完全反应,铁的量决定氢气的体积,能够加快反应速率,又不影响产生H2的总量,采取措施有:形成原电池,注意形成原电池是不能消耗铁,升高温度,改变铁粉的颗粒大小,增大氢离子的浓度等,以此解答该题.
解答 解:①铁片固体表面积减小,则反应速率减小,故错误;
②铜粉可形成原电池反应,反应速率增大,故正确;
③加入少量浓硫酸,浓度增大,可增大反应速率,故正确;
④石墨,可与铁形成原电池反应,可增大反应速率,故正确;
⑤二氧化锰,不能改变反应速率,故错误;
⑥饱和食盐水,溶液体积增大,浓度减小,反应速率减小,故错误;
⑦CuSO4 形成原电池,加快反应,但消耗铁,生成氢气的总量减小,故错误;
⑧NaNO3晶体时,硝酸根离子在酸性条件下具有强氧化性,与铁反应不生成氢气,故错误.
故选B.
点评 本题考查化学反应速率的影响元素,为高频考点,侧重于学生的分析能力的考查,难度中等,注意加入氧化铜、Fe粉对氢气总量的影响,是本题的易错点.

练习册系列答案
相关题目
1.下列各组顺序,正确的是( )
| A. | 微粒半径大小:S2->Cl->Na+>Al3+>F- | |
| B. | 热稳定性大小:SiH4>PH3>NH3 | |
| C. | 相同条件下与水反应的剧烈程度:Rb>K>Na>Li | |
| D. | 酸性强弱顺序:HClO4<H2SO4<H3PO4<H2SiO3 |
6.分析表中各项的排布规律,按此规律排布第23项应为( )
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| C2H6 | C2H4 | C2H4O2 | C3H8 | C3H6 | C3H6O2 | C4H10 | C4H8 | C4H8O2 | C5H12 |
| A. | C9H18 | B. | C9H118O2 | C. | C8H18 | D. | C8H16O2 |
3.下列叙述错误的是( )
| A. | 可以用溴水鉴别丙烯和苯 | |
| B. | 用无水硫酸铜可以检验酒精中是否含有水 | |
| C. | 可以用氢氧化钠溶液鉴别乙醇和乙酸 | |
| D. | 可以用烧灼的方法鉴别真丝布料和纯棉布料 |
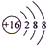 .A+、C2-、D-中离子半径最小的是Na+.(用具体离子符号表示)
.A+、C2-、D-中离子半径最小的是Na+.(用具体离子符号表示)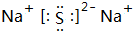 .
.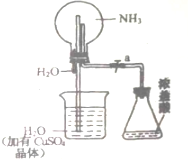 如图,室温下,挤压胶头滴管.待现象发生时,再打开活塞a,烧瓶中能观察到的现象是先形成蓝色喷泉,然后有蓝色沉淀生成后溶解变为蓝色溶液,有关的化学方程式是NH3+H2O=NH3.H2O、CuSO4+2NH3.H2O=Cu(OH)2↓+(NH4)2SO4、Cu(OH)2+2HCl=CuCl2+H2O.
如图,室温下,挤压胶头滴管.待现象发生时,再打开活塞a,烧瓶中能观察到的现象是先形成蓝色喷泉,然后有蓝色沉淀生成后溶解变为蓝色溶液,有关的化学方程式是NH3+H2O=NH3.H2O、CuSO4+2NH3.H2O=Cu(OH)2↓+(NH4)2SO4、Cu(OH)2+2HCl=CuCl2+H2O.