题目内容
7.下列分类或归类不正确的是( )①蓝矾、液态氯化氢、冰水混合物均为纯净物②Mn2O7、P2O5、SO3、CO2均属于酸性氧化物③明矾、烧碱、硫酸钡均为强电解质④C60、金刚石、石墨均为碳的同素异形体⑤蛋白质溶液、淀粉溶液、雾、墨水均为胶体.| A. | 无 | B. | ①②⑤ | C. | ①②④⑤ | D. | ①②③ |
分析 ①只由一种物质构成的是纯净物;
②能和碱反应生成盐和水的氧化物为酸性氧化物;
③在水溶液中能完全电离的电解质为强电解质;
④由同种元素形成的不同种单质间互为同素异形体;
⑤常见的胶体有河水、大气、淀粉溶液、蛋白质溶液、雾和墨水等.
解答 解:①只由一种物质构成的是纯净物,故蓝矾、液态氯化氢、冰水混合物为纯净物,故正确;
②Mn2O7、P2O5、SO3、CO2均能和碱反应生成盐和水,故为酸性氧化物,故正确;
③明矾、烧碱、硫酸钡在水溶液中能完全电离,故为强电解质,故正确;
④C60、金刚石、石墨是由同种元素形成的不同种单质,故互为同素异形体,故正确;
⑤常见的胶体有河水、大气、淀粉溶液、蛋白质溶液、雾和墨水、血液等,故蛋白质溶液、淀粉溶液、雾、墨水均为胶体,故正确,
故选A.
点评 本题考查了常见的化学用语,难度不大,应注意的是酸性氧化物的辨别和强电解质的概念.

练习册系列答案
相关题目
17.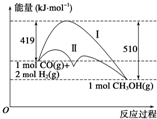 利用含碳化合物合成燃料是解决能源危机的重要方法,已知CO(g)+2H2(g)?CH3OH(g)反应过程中的能量变化情况如图所示,曲线Ⅰ和曲线Ⅱ分别表示不使用催化剂和使用催化剂的两种情况.下列判断正确的是( )
利用含碳化合物合成燃料是解决能源危机的重要方法,已知CO(g)+2H2(g)?CH3OH(g)反应过程中的能量变化情况如图所示,曲线Ⅰ和曲线Ⅱ分别表示不使用催化剂和使用催化剂的两种情况.下列判断正确的是( )
 利用含碳化合物合成燃料是解决能源危机的重要方法,已知CO(g)+2H2(g)?CH3OH(g)反应过程中的能量变化情况如图所示,曲线Ⅰ和曲线Ⅱ分别表示不使用催化剂和使用催化剂的两种情况.下列判断正确的是( )
利用含碳化合物合成燃料是解决能源危机的重要方法,已知CO(g)+2H2(g)?CH3OH(g)反应过程中的能量变化情况如图所示,曲线Ⅰ和曲线Ⅱ分别表示不使用催化剂和使用催化剂的两种情况.下列判断正确的是( )| A. | 该反应的△H=+91 kJ•mol-1 | |
| B. | 加入催化剂,该反应的△H变小 | |
| C. | 反应物的总能量小于生成物的总能量 | |
| D. | 如果该反应生成液态CH3OH,则△H减小 |
18.下列说法不正确的是( )
| A. | 用激光笔检验豆浆的丁达尔现象 | |
| B. | 胶体的分散质粒子直径小于l00nm但大于1nm,能通过滤纸,不能透过半透膜 | |
| C. | 存在自由移动的离子是电解质溶液导电的原因 | |
| D. | 用萃取的方法分离汽油和煤油 |
12.下列关于铁与水反应的描述中,不正确的是( )
| A. | 铁与水蒸气反应的产物是黑色的Fe2O3 | |
| B. | 红热的铁能与水蒸气反应,放出的气体点燃时能发出爆鸣声 | |
| C. | 铁与水蒸气的反应是氧化还原反应 | |
| D. | 常温下,Fe与H2O不反应,但在空气中的O2、H2O共同作用下能发生反应 |
7.草酸是一种重要的化工原料,广泛用于药物生产、高分子合成等工业.某学习小组的同学拟以甘蔗渣为原料用水解-氧化-水解循环进行制取草酸.查阅资料得知:
(1)易溶于乙醇和水,微溶于乙醚(易挥发),难溶于苯和四氯化碳.
(2)草酸具有很强的还原性
请跟据以上信息回答下列问题:
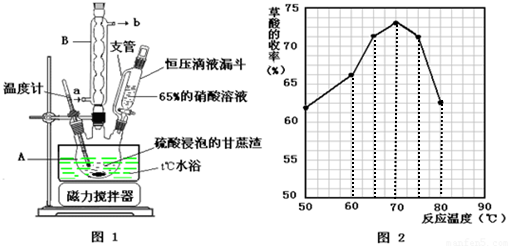
(1)氧化-水解过程是在上图1的装置中进行的,指出装置A的名称三颈烧瓶.
(2)氧化-水解过程中,在硝酸用量、反应的时间等条件均相同的情况下,改变反应温度以考察反应温度对草酸产率的影响,结果如上图2所示,请选择最佳的反应温度为70℃,实验中若混酸滴加过快或温度过高,将导致草酸产率下降,其原因是草酸易被浓硫酸或硝酸氧化.
(3)得到粗产品后,洗涤时选择乙醚 作洗涤剂,理由是易挥发,无残留.
(4)为了确定产品中H2C2O4•2H2O(M=126g/mol)的纯度,称取10.0g草酸样品,配成250mL溶液,每次实验时准确量取25.00mL草酸溶液,加入适量的稀硫酸,用0.1mol/LKMnO4标准溶液滴定.平行滴定三次,重复滴定三次,每次消耗KMnO4标准溶液的体积如下表所示
①写出滴定过程中的离子方程式5H2C2O4+2MnO4-+6H+=2Mn2++10CO2↑+8H2O.
②在草酸纯度测定的实验过程中,下列说法正确的是:CD.
A.配制标准液时,若KMnO4不纯(杂质不与待测液反应),会使实验误差偏低
B.润洗滴定管时,应从滴定管上口加满所需的酸或碱液,使滴定管内壁充分润洗
C.滴定时,眼睛注视锥形瓶,观察溶液颜色变化
D.滴定终点读取滴定管刻度时,仰视标准液液面,会使实验误差偏高
③判断滴定已经达到终点的方法是:向锥形瓶中滴入最后一滴高锰酸钾标准液,锥形瓶中溶液变成浅红色且半分钟后不变色.
④草酸晶体的纯度为50.4%.
(1)易溶于乙醇和水,微溶于乙醚(易挥发),难溶于苯和四氯化碳.
(2)草酸具有很强的还原性

请跟据以上信息回答下列问题:
(1)氧化-水解过程是在上图1的装置中进行的,指出装置A的名称三颈烧瓶.
(2)氧化-水解过程中,在硝酸用量、反应的时间等条件均相同的情况下,改变反应温度以考察反应温度对草酸产率的影响,结果如上图2所示,请选择最佳的反应温度为70℃,实验中若混酸滴加过快或温度过高,将导致草酸产率下降,其原因是草酸易被浓硫酸或硝酸氧化.
(3)得到粗产品后,洗涤时选择乙醚 作洗涤剂,理由是易挥发,无残留.
(4)为了确定产品中H2C2O4•2H2O(M=126g/mol)的纯度,称取10.0g草酸样品,配成250mL溶液,每次实验时准确量取25.00mL草酸溶液,加入适量的稀硫酸,用0.1mol/LKMnO4标准溶液滴定.平行滴定三次,重复滴定三次,每次消耗KMnO4标准溶液的体积如下表所示
| 第一次 | 第二次 | 第三次 | |
| 体积(mL) | 16.10mL | 16.60mL | 15.90mL |
②在草酸纯度测定的实验过程中,下列说法正确的是:CD.
A.配制标准液时,若KMnO4不纯(杂质不与待测液反应),会使实验误差偏低
B.润洗滴定管时,应从滴定管上口加满所需的酸或碱液,使滴定管内壁充分润洗
C.滴定时,眼睛注视锥形瓶,观察溶液颜色变化
D.滴定终点读取滴定管刻度时,仰视标准液液面,会使实验误差偏高
③判断滴定已经达到终点的方法是:向锥形瓶中滴入最后一滴高锰酸钾标准液,锥形瓶中溶液变成浅红色且半分钟后不变色.
④草酸晶体的纯度为50.4%.
4.某化学研究性学习小组通过查阅资料,设计了如下图所示的方法以含镍废催化剂为原料来制备NiSO4•7H2O.已知某化工厂的含镍催化剂主要含有Ni,还含有Al(31%)、Fe(1.3%)的单质及氧化物,其他不溶杂质(3.3%).

部分阳离子以氢氧化物形式开始沉淀和完全沉淀时的pH如下:
回答下列问题:
(1)操作a、c中需使用的仪器除铁架台(带铁圈)、酒精灯、烧杯、玻璃棒外还需要的两种仪器为漏斗、蒸发皿.
(2)“碱浸”过程中发生的离子方程式是2Al+2OH-+2H2O═2AlO2-+3H2↑、Al2O3+2OH-═2AlO2-+H2O.
“酸浸”时所加入的酸是H2SO4(填化学式).酸浸后,经操作a分离出固体①后,溶液中可能含有的金属离子是Ni2+、Fe2+.
(3)调节溶液PH为2~3的目的是防止在浓缩结晶过程中Ni2+水解.
(4)产品晶体中有时会混有少量绿矾(FeSO4•7H2O),其原因可能是H2O2的用量不足(或H2O2失效)、保温时间不足导致Fe2+未被完全氧化造成的.(回答一点即可)
(5)现有100千克含镍催化剂,如果酸浸步骤镍浸出率为a%,其它物质全部参与反应,且假定镍在酸浸后续步骤无损失.操作C后粗晶体中含绿矾b%,则最终能得到粗晶体$\frac{100×64.4%×a%×281}{(1-b%)×59}$千克(Ni-59 NiSO4•7H2O-281)(只要求写出计算表达式).若要进一步提纯晶体,需进行的操作是重结晶.

部分阳离子以氢氧化物形式开始沉淀和完全沉淀时的pH如下:
| 沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Ni(OH)2 |
| 开始沉淀pH | 3.4 | 1.8 | 7.5 | 7.2 |
| 完全沉淀pH | 5.2 | 3.2 | 9.7 | 9.2 |
(1)操作a、c中需使用的仪器除铁架台(带铁圈)、酒精灯、烧杯、玻璃棒外还需要的两种仪器为漏斗、蒸发皿.
(2)“碱浸”过程中发生的离子方程式是2Al+2OH-+2H2O═2AlO2-+3H2↑、Al2O3+2OH-═2AlO2-+H2O.
“酸浸”时所加入的酸是H2SO4(填化学式).酸浸后,经操作a分离出固体①后,溶液中可能含有的金属离子是Ni2+、Fe2+.
(3)调节溶液PH为2~3的目的是防止在浓缩结晶过程中Ni2+水解.
(4)产品晶体中有时会混有少量绿矾(FeSO4•7H2O),其原因可能是H2O2的用量不足(或H2O2失效)、保温时间不足导致Fe2+未被完全氧化造成的.(回答一点即可)
(5)现有100千克含镍催化剂,如果酸浸步骤镍浸出率为a%,其它物质全部参与反应,且假定镍在酸浸后续步骤无损失.操作C后粗晶体中含绿矾b%,则最终能得到粗晶体$\frac{100×64.4%×a%×281}{(1-b%)×59}$千克(Ni-59 NiSO4•7H2O-281)(只要求写出计算表达式).若要进一步提纯晶体,需进行的操作是重结晶.
5.下列叙述中正确的是( )
| A. | 纯碱(Na2CO3)从物质的分类看不属于碱 | |
| B. | 由一种元素组成的物质一定是单质 | |
| C. | 凡是能电离出H+的化合物均属于酸 | |
| D. | 盐类物质一定含有金属离子 |