题目内容
6.酸与碱发生中和反应生成1molH2O时所释放的能量称为中和热,按如下步骤测定中和热:在50mL烧杯中加入20mL 2mol•L-1的盐酸,测其温度;量取20mL 2mol•L-1NaOH溶液,测其温度;将NaOH溶液缓慢倾入烧杯中,边加边用玻璃棒搅拌,记录溶液温度变化过程.
(1)实验中随着NaOH溶液的加入,溶液温度的变化情况是先升高后降低.
(2)若根据实验数据计算反应放出的热量共2.28kJ,则中和热为57kJ•mol-1.
分析 (1)NaOH与盐酸反应放热,温度升高,完全反应后,温度降低;
(2)中和热是指稀的强酸和强碱反应生成1mol水所放出的热量;
解答 解:(1)实验中随着NaOH溶液的加入,NaOH与盐酸反应放热,温度升高,完全反应后,温度降低,所以溶液温度的变化情况是先升高后降低;
故答案为:先升高后降低;
(2)20mL2mol•L-1的盐酸与20mL2mol•L-1NaOH溶液完全反应,放出2.28kJ的热量,即生成0.04mol水放出2.28kJ的热量,反应的中和热为$\frac{2.28kJ}{0.04mol}$=57kJ/mol;
故答案为:57;
点评 本题考查中和热的测定与反应热的计算,题目难度大,注意理解中和热概念,试题有利于培养学生灵活应用所学知识的能力.

练习册系列答案
相关题目
16.下列有关氧元素及其化合物表示正确的是( )
| A. | 质子数为8、中子数为10的氧原子:${\;}_{16}^{8}$O | |
| B. | 氧原子的结构示意图: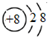 | |
| C. | 过氧化氢的电子式: | |
| D. | 乙酸甲酯的结构简式HCOOC2H5 |
17.把下列四种X溶液分别加入四个盛有l0mL2mol/L盐酸的烧杯中,均加水稀释到50mL,此时,X和盐酸进行反应,其中反应速率最快的是( )
| A. | 10℃20mL 3mol/L的X溶液 | B. | 20℃l0mL 5mol/L的X溶液 | ||
| C. | 20℃30mL 2mol/L的X溶液 | D. | 10℃l0mL2mol/L的X溶液 |
14.下列说法正确的是( )
| A. | 离子键是指阴阳离子间的静电引力 | |
| B. | 离子化合物是指只含有离子键的化合物 | |
| C. | 升高温度只能使吸热反应的速率增大,不能使放热反应的速率增大 | |
| D. | 粉碎固体反应物可以增大反应速率 |
1.不属于等电子体的一组的是( )
| A. | CH4和NH4+ | B. | CO32-和NO3- | C. | CO和N2 | D. | H2O和CH4 |
18.能够说明氨水是弱碱的事实是( )
| A. | 氨水具有挥发性 | |
| B. | 1mol/L氨水溶液的pH=10 | |
| C. | 1mol/LNH4Cl溶液的pH=5 | |
| D. | 氨水与AlCl3溶液反应生成Al(OH)3沉淀 |
14.化学与环境、生活密切相关,下列与化学有关的说法正确的是( )
| A. | 春节燃放爆竹对环境无污染 | |
| B. | “酸雨”是由大气中的碳、氮、硫的氧化物溶于雨水造成 | |
| C. | 雾霾是一种分散系,分散剂是空气,带活性炭口罩防雾霾的原理是吸附原理 | |
| D. | 光化学烟雾的产生与人为排放大气污染物氮氧化物无关 |
 ,反应的化学方程式为
,反应的化学方程式为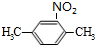 +H2O.
+H2O.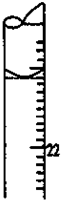 某学生用0.1000mol•L-1标准氢氧化钠溶液滴定未知浓度的盐酸溶液,其操作可分解为如下几步:
某学生用0.1000mol•L-1标准氢氧化钠溶液滴定未知浓度的盐酸溶液,其操作可分解为如下几步: