题目内容
被污染的空气严重危害人体健康,常见的空气污染物有CO、NO、NO2、SO2等.
(1)汽车尾气净化的主要原理为:若该反应在绝热、恒容的密闭体系中进行,下列示意图正确且能说明反应在进行到t1时刻达到平衡状态的是 (填代号).
(2)煤燃烧产生的烟道气中常含有CO、SO2等污染性气体,处理烟道气中CO、SO2的一种方法,是将其在催化剂作用下转化为单质S(g).
已知:CO(g)+
O2(g)=CO2(g)△H=一283.0kJ.mol-1
S(g)+O2(g)=SO2(g)△H=-296.0kJ.mol-1
试写出利用上述方法处理烟道气的热化学方程式 .
(3)298K时,在2L的密闭容器中,发生可逆反应:2NO2(g)N2O4(g)△H=-akJ?mol-1(a>0).N2O4
的物质的量浓度随时间变化如图2.达平衡时,N2O4的浓度为NO2的2倍,回答下列问题.
①0-20s区间的平均反应速率v(NO2)= .
②下列条件的改变一定能加快反应速率并且提高NO2的转化率的是 (填代号).
A.升高反应温度 B.缩小容器的体积C.保持容器体积不变,充入稀有气体 D.保持容器体积不变,充人NO2气体
③298K时,该反应的平衡常数为 L.mol-1(小数点后保留两位).若反应在398K时进行,某时刻测得n(NO2)=0.6mo1,n(N2O4)=1.2mol,则此时v(正) v(逆)(填“>”“<”或“=”).
(4)某化学兴趣小组构想将NO转化为HNO3,装置如图3,电极为多孔惰性材料,则负极的电极反应式为 .当导线上有0.4mole-通过时,通入氧气一端的硝酸溶液质量增加 克.
(1)汽车尾气净化的主要原理为:若该反应在绝热、恒容的密闭体系中进行,下列示意图正确且能说明反应在进行到t1时刻达到平衡状态的是

(2)煤燃烧产生的烟道气中常含有CO、SO2等污染性气体,处理烟道气中CO、SO2的一种方法,是将其在催化剂作用下转化为单质S(g).
已知:CO(g)+
| 1 |
| 2 |
S(g)+O2(g)=SO2(g)△H=-296.0kJ.mol-1
试写出利用上述方法处理烟道气的热化学方程式
(3)298K时,在2L的密闭容器中,发生可逆反应:2NO2(g)N2O4(g)△H=-akJ?mol-1(a>0).N2O4
的物质的量浓度随时间变化如图2.达平衡时,N2O4的浓度为NO2的2倍,回答下列问题.
①0-20s区间的平均反应速率v(NO2)=
②下列条件的改变一定能加快反应速率并且提高NO2的转化率的是
A.升高反应温度 B.缩小容器的体积C.保持容器体积不变,充入稀有气体 D.保持容器体积不变,充人NO2气体
③298K时,该反应的平衡常数为
(4)某化学兴趣小组构想将NO转化为HNO3,装置如图3,电极为多孔惰性材料,则负极的电极反应式为
考点:化学平衡的计算,用盖斯定律进行有关反应热的计算,原电池和电解池的工作原理,化学平衡状态的判断
专题:
分析:(1)A、到达平衡后正、逆速率相等,不再变化;
B、到达平衡后,温度为定值,平衡常数不变,结合反应热判断随反应进行容器内温度变化,判断温度对化学平衡常数的影响;
C、到达平衡后各组分的含量不发生变化;
D、t1时刻后二氧化碳、CO的物质的量发生变化,最后不再变化;
(2)利用盖斯定律进行书写;
(3)①根据图象计算0-20s区间的平均反应速率v(N2O4),再根据速率之比等于系数之比计算v(NO2);
②A.根据反应放热,所以升高反应温度平衡向逆向移动分析;
B.缩小容器的体积,即增大压强,平衡正向移动;
C.保持容器体积不变,充入稀有气体,平衡不移动;
D.保持容器体积不变,充人NO2气体,采用先成比例增大体积,转化率不变,再压缩到原来的体积,平衡正向移动;
③有图可知N2O4的平衡浓度为0.6mol/L,达到平衡时,N2O4的浓度为NO2的2倍,则NO2的平衡浓度为0.3mol/L,带入平衡常数表达式计算;
反应为放热反应,升高温度,K值减小,计算可知此时的浓度商Q=K(298K)>K(398K),反应向逆反应方向移动,因此V(正)<V(逆);
(4)在原电池的负极上发生失电子的氧化反应.
B、到达平衡后,温度为定值,平衡常数不变,结合反应热判断随反应进行容器内温度变化,判断温度对化学平衡常数的影响;
C、到达平衡后各组分的含量不发生变化;
D、t1时刻后二氧化碳、CO的物质的量发生变化,最后不再变化;
(2)利用盖斯定律进行书写;
(3)①根据图象计算0-20s区间的平均反应速率v(N2O4),再根据速率之比等于系数之比计算v(NO2);
②A.根据反应放热,所以升高反应温度平衡向逆向移动分析;
B.缩小容器的体积,即增大压强,平衡正向移动;
C.保持容器体积不变,充入稀有气体,平衡不移动;
D.保持容器体积不变,充人NO2气体,采用先成比例增大体积,转化率不变,再压缩到原来的体积,平衡正向移动;
③有图可知N2O4的平衡浓度为0.6mol/L,达到平衡时,N2O4的浓度为NO2的2倍,则NO2的平衡浓度为0.3mol/L,带入平衡常数表达式计算;
反应为放热反应,升高温度,K值减小,计算可知此时的浓度商Q=K(298K)>K(398K),反应向逆反应方向移动,因此V(正)<V(逆);
(4)在原电池的负极上发生失电子的氧化反应.
解答:
解:(1)依据图象分析判断选项;
A、到达平衡后正、逆速率相等,不再变化,t1时刻V正最大,之后随反应进行速率发生变化,未到达平衡,故A错误;
B、该反应正反应为放热反应,随反应进行温度升高,化学平衡常数减小,到达平衡后,温度为定值,达最高,平衡常数不变,为最小,图象与实际符合,故B正确;
C、NO的质量分数为定值,t1时刻处于平衡状态,故C正确,
D、t1时刻后二氧化碳、CO的物质的量发生变化,t1时刻未到达平衡状态,故D错误;
故答案为:BC;
(2)①CO(g)+
O2(g)=CO2(g)△H=-283.0KJ?mol-1
②S(g)+O2(g)=SO2(g)△H=-296.0KJ?mol-1
将方程式①×2-②得2CO(g)+SO2(g)=S(g)+2CO2(g)△H=(-283.0KJ?mol-1)×2-(-296.0KJ?mol-1)=-270KJ?mol-1,热化学反应方程式为:2CO(g)+SO2(g)=S(g)+2CO2(g)△H=-270KJ?mol-1,
故答案为:2CO(g)+SO2(g)=S(g)+2CO2(g)△H=-270KJ?mol-1;
(3)①由图象0-20s区间的平均反应速率v(N2O4)=
=0.015mol/(L?S),又速率之比等于系数之比则v(NO2)=2×0.015mol/(L?S)=0.03mol/(L?S);
故答案为:0.03mol/(L?S);
②A.根据反应放热,所以升高反应温度平衡向逆向移动,转化率减小,故错误;
B.缩小容器的体积,即增大压强,平衡正向移动,转化率增大,故正确;
C.保持容器体积不变,充入稀有气体,平衡不移动,转化率不变,故错误;
D.保持容器体积不变,充人NO2气体,采用先成比例增大体积,转化率不变,再压缩到原来的体积,平衡正向移动,转化率增大,故正确;
故答案为:BD;
③有图可知N2O4的平衡浓度为0.6mol/L,达到平衡时,N2O4的浓度为NO2的2倍,则NO2的平衡浓度为0.3mol/L,
则K=
=
=6.67L/mol,
反应为放热反应,升高温度,K值减小,密闭容器的体积为2L,因此的N2O4的浓度为0.6mol/L,N2O4的浓度为0.3mol/L,浓度商Q=
=
=6.67L/mol=K(298K)>K(398K),反应向逆反应方向移动,因此V(正)<V(逆);
故答案为:6.67;<;
(4)将NO转化为HNO3的原电池中,负极上发生一氧化氮失电子的氧化反应,即NO-3e-+2H2O=NO3-+4H+,当导线上有0.4mole-通过时,氧气一端的反应为:4H++4e-+O2=2H2O,则质量增加为0.2mol水的质量,即0.2×18=3.6g,故答案为:NO-3e-+2H2O=NO3-+4H+;3.6;
A、到达平衡后正、逆速率相等,不再变化,t1时刻V正最大,之后随反应进行速率发生变化,未到达平衡,故A错误;
B、该反应正反应为放热反应,随反应进行温度升高,化学平衡常数减小,到达平衡后,温度为定值,达最高,平衡常数不变,为最小,图象与实际符合,故B正确;
C、NO的质量分数为定值,t1时刻处于平衡状态,故C正确,
D、t1时刻后二氧化碳、CO的物质的量发生变化,t1时刻未到达平衡状态,故D错误;
故答案为:BC;
(2)①CO(g)+
| 1 |
| 2 |
②S(g)+O2(g)=SO2(g)△H=-296.0KJ?mol-1
将方程式①×2-②得2CO(g)+SO2(g)=S(g)+2CO2(g)△H=(-283.0KJ?mol-1)×2-(-296.0KJ?mol-1)=-270KJ?mol-1,热化学反应方程式为:2CO(g)+SO2(g)=S(g)+2CO2(g)△H=-270KJ?mol-1,
故答案为:2CO(g)+SO2(g)=S(g)+2CO2(g)△H=-270KJ?mol-1;
(3)①由图象0-20s区间的平均反应速率v(N2O4)=
| 0.3 |
| 20 |
故答案为:0.03mol/(L?S);
②A.根据反应放热,所以升高反应温度平衡向逆向移动,转化率减小,故错误;
B.缩小容器的体积,即增大压强,平衡正向移动,转化率增大,故正确;
C.保持容器体积不变,充入稀有气体,平衡不移动,转化率不变,故错误;
D.保持容器体积不变,充人NO2气体,采用先成比例增大体积,转化率不变,再压缩到原来的体积,平衡正向移动,转化率增大,故正确;
故答案为:BD;
③有图可知N2O4的平衡浓度为0.6mol/L,达到平衡时,N2O4的浓度为NO2的2倍,则NO2的平衡浓度为0.3mol/L,
则K=
| c(N 2O 4) |
| c 2(NO2) |
| 0.6mol/L |
| (0.3mol/L) 2 |
反应为放热反应,升高温度,K值减小,密闭容器的体积为2L,因此的N2O4的浓度为0.6mol/L,N2O4的浓度为0.3mol/L,浓度商Q=
| c(N 2O 4) |
| c 2(NO2) |
| 0.6mol/L |
| (0.3mol/L) 2 |
故答案为:6.67;<;
(4)将NO转化为HNO3的原电池中,负极上发生一氧化氮失电子的氧化反应,即NO-3e-+2H2O=NO3-+4H+,当导线上有0.4mole-通过时,氧气一端的反应为:4H++4e-+O2=2H2O,则质量增加为0.2mol水的质量,即0.2×18=3.6g,故答案为:NO-3e-+2H2O=NO3-+4H+;3.6;
点评:本题考查学生热化学、电化学以及化学平衡的有关计算知识,是考试的重点和难点,难度中等.

练习册系列答案
 小学教材全测系列答案
小学教材全测系列答案 小学数学口算题卡脱口而出系列答案
小学数学口算题卡脱口而出系列答案 优秀生应用题卡口算天天练系列答案
优秀生应用题卡口算天天练系列答案
相关题目
分别称取0.2gNaOH固体两份,加适量的蒸馏水溶解,用未知浓度的盐酸滴定,若两次所消耗盐酸的体积分别为25.02mL、24.98mL,下列说法中正确的是( )
| A、若盐酸的浓度为0.2mol/L,则第一次测出的盐酸的浓度偏高 |
| B、若NaOH中混有少量的Na2CO3,则测定的结果偏高 |
| C、开始读数时仰视滴定管读数,滴定结束时也仰视滴定管读数,对实验结果无影响 |
| D、第二次测定的数据可能是由于滴定时不小心把盐酸滴到锥形瓶外面引起的 |
下列实验目的无法实现的是( )
| A、用激光笔光束鉴别氯化铁溶液和氢氧化铁胶体 |
| B、用KSCN溶液鉴别Fe3+和Fe2+ |
| C、用氨水鉴别Al3+和Mg2+ |
| D、用焰色反应鉴别碳酸钠溶液和碳酸钾溶液 |
向22.4gFe2O3、Cu的混合物中加入0.5mol/L的硫酸溶液750mL,固体完全溶解,则原混合物中Cu的质量可能为( )
| A、1.12 g |
| B、2.2 g |
| C、3.2g |
| D、6.4g |
下列各组中的两种物质作用时,反应条件(温度、反应物用量、浓度)改变,不会引起产物种类改变的是( )
| A、Fe和Cl2 |
| B、NaOH和SO2 |
| C、Na和O2 |
| D、C和O2 |
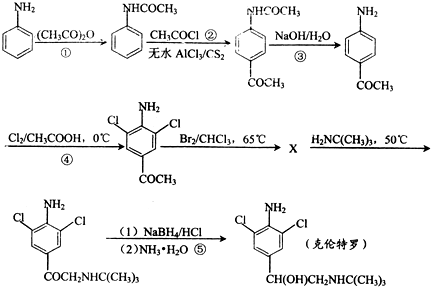
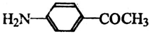 ) 的同分异构体有多种,请写出符合以下条件的其中任意一种
) 的同分异构体有多种,请写出符合以下条件的其中任意一种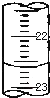 某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:
某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下: