题目内容
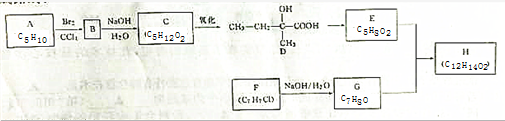
一定条件下,氨气和一氧化氮反应的方程式为:4NH3+6NO
5N2+6H2O,在该反应中,被氧化的物质是 (填化学式),作为氧化剂的物质是 (填化学式);若反应中消耗了4mol NH3,则生成 mol N2.
| ||
| △ |
考点:氧化还原反应
专题:氧化还原反应专题
分析:4NH3+6NO
5N2+6H2O,在该反应中,氨气中N元素的化合价升高,NO中N元素的化合价降低,以此来解答.
| ||
| △ |
解答:
解:4NH3+6NO
5N2+6H2O,在该反应中,氨气中N元素的化合价升高,则NH3为还原剂,被氧化;NO中N元素的化合价降低,则NO为氧化剂,反应中消耗了4mol NH3,生成氮气的物质的量为5mol,
故答案为:NH3;NO;5.
| ||
| △ |
故答案为:NH3;NO;5.
点评:本题考查氧化还原反应,把握反应中元素的化合价变化为解答的关键,侧重氧化还原反应基本概念及计算的考查,注意元素化合价的判断,题目难度不大.

练习册系列答案
相关题目
下列关于纯净物、混合物、强电解质、弱电解质和非电解质的正确组合是( )
| 纯净物 | 混合物 | 强电解质 | 弱电解质 | 非电解质 | |
| A | 盐酸 | 玻璃 | 硫酸 | 氨水 | 干冰 |
| B | 氢氧化钡 | 植物油 | 硫酸钡 | 醋酸 | 水 |
| C | 胆矾 | 淀粉 | 熟石灰 | 水 | 氨气 |
| D | 硝酸 | 汽油 | 硫酸 | 氢硫酸 | 氢气 |
| A、A | B、B | C、C | D、D |
以下物质的性质只与温度有关的是( )
| A、氨气的溶解度 |
| B、水的离子积 |
| C、高锰酸钾的氧化性 |
| D、醋酸的电离度 |
暴露于空气中不易变质的是( )
| A、水玻璃 |
| B、苏打 |
| C、Na2O2 |
| D、漂白液 |