题目内容
向22.4gFe2O3、Cu的混合物中加入0.5mol/L的硫酸溶液750mL,固体完全溶解,则原混合物中Cu的质量可能为( )
| A、1.12 g |
| B、2.2 g |
| C、3.2g |
| D、6.4g |
考点:有关混合物反应的计算
专题:计算题
分析:铜不与硫酸反应,则溶解铜的反应为:2Fe3++Cu═2Fe2++Cu2+,当铁离子与铜恰好反应时,铜的物质的量最小,设出氧化铁、铜的物质的量,分别根据质量及反应方程式列式计算,得出铜的最大质量;再利用极值法计算出混合物中最多含有氧化铁的质量,从而得出混合物中铜的最小质量,最后根据计算结果对各选项进行判断.
解答:
解:①溶解铜的反应方程式为:2Fe3++Cu═2Fe2++Cu2+,当铁离子与铜恰好反应时,铜的质量有最大值,
设混合物中含有氧化铁xmol、铜ymol,160x+64y=22.4,根据反应2Fe3++Cu═2Fe2++Cu2+可知,x=y,
解得:x=y=0.1mol,铜的质量为:64g/mol×0.1mol=6.4g;
②750mL 0.5mol/L的硫酸中含有溶质硫酸的物质的量为0.375mol,根据反应关系式Fe2O3~3H2SO4可知,0.375mol硫酸完全反应最多消耗氧化铁的物质的量为:0.375mol×
=0.125mol,此时氧化铁的质量为:160g/mol×0.125mol=20g,所以混合物中含有铜的质量一定大于::22.4g-20g=2.4g,
根据以上分析可知,满足条件的为C、D,
故选CD.
设混合物中含有氧化铁xmol、铜ymol,160x+64y=22.4,根据反应2Fe3++Cu═2Fe2++Cu2+可知,x=y,
解得:x=y=0.1mol,铜的质量为:64g/mol×0.1mol=6.4g;
②750mL 0.5mol/L的硫酸中含有溶质硫酸的物质的量为0.375mol,根据反应关系式Fe2O3~3H2SO4可知,0.375mol硫酸完全反应最多消耗氧化铁的物质的量为:0.375mol×
| 1 |
| 3 |
根据以上分析可知,满足条件的为C、D,
故选CD.
点评:本题考查了有关混合物反应的计算,题目难度中等,本题中需要通过讨论得出原混合物中铜的质量范围,增大了试题难度,注意掌握讨论法在化学计算中的应用方法,试题培养了学生的分析、理解能力及化学计算能力.

练习册系列答案
相关题目
下列实验操作中,正确的是( )
| A、在CuSO4溶液中滴入少量NaOH溶液,来配制新制Cu(OH)2 |
| B、在稀氨水中逐渐加入稀的硝酸银溶液来配制银氨溶液 |
| C、除去苯中的少量苯酚:加入NaOH溶液,振荡、静置分层后,除去水层 |
| D、溴乙烷在氢氧化钠存在下进行水解后,加入硝酸银溶液,可检验溴离子的存在 |
丁腈橡胶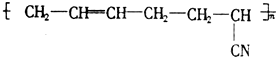 具有优良的耐油、耐高温性能,合成丁腈橡胶的原料是( )
具有优良的耐油、耐高温性能,合成丁腈橡胶的原料是( )
①CH2=CH-CH=CH2
②CH3-C≡C-CH3
③CH2=CH-CN
④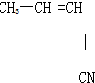
⑤CH3-CH═CH2
⑥CH3-CH=CH-CH.
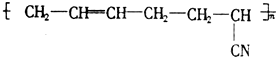 具有优良的耐油、耐高温性能,合成丁腈橡胶的原料是( )
具有优良的耐油、耐高温性能,合成丁腈橡胶的原料是( )①CH2=CH-CH=CH2
②CH3-C≡C-CH3
③CH2=CH-CN
④
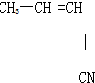
⑤CH3-CH═CH2
⑥CH3-CH=CH-CH.
| A、③⑥ | B、②③ | C、①③ | D、④⑤ |
某苯的衍生物,含有两个互为对位的取代基,其分子式为C8H10O,其中不跟NaOH溶液反应的衍生物种类有( )
| A、2种 | B、3种 | C、4种 | D、5种 |