题目内容
如图是实验室中制备气体或验证气体性质的装置图:

(1)仪器a的名称是
(2)利用上图装置,可选用浓盐酸和二氧化锰制备纯净、干燥的氯气.
①圆底烧瓶内发生反应的化学方程式为
②装置B中的溶液为
烧杯E中溶液的作用为
(3)利用上图装置,也可选用用浓盐酸和KMnO4固体制取纯净、干燥的氯气.反应原理(离子方程式)如下,试完成并配平:
+ Cl-+ H+═ Mn2++ Cl2↑+ .

(1)仪器a的名称是
(2)利用上图装置,可选用浓盐酸和二氧化锰制备纯净、干燥的氯气.
①圆底烧瓶内发生反应的化学方程式为
②装置B中的溶液为
烧杯E中溶液的作用为
(3)利用上图装置,也可选用用浓盐酸和KMnO4固体制取纯净、干燥的氯气.反应原理(离子方程式)如下,试完成并配平:
考点:常见气体制备原理及装置选择
专题:实验题
分析:(1)依据装置图分析仪器a为分液漏斗;
(2)①依据实验室制备氯气的反应是二氧化锰和浓盐酸加热反应生成氯化锰、氯气和水;
②依据氯气含有氯化氢和水蒸气分析装置B的作用,氯气是有毒气体不能排放到空气中;
(3)反应中KMnO4→MnCl2,Mn元素化合价由+7降低为+2,共降低5价,HCl(浓)→Cl2,Cl元素化合价由-1价升高为0价,共升高为2价,化合价升降最小公倍数为10,故KMnO4的系数为2,Cl2的系数为5,再根据原子守恒配平其它物质的系数.
(2)①依据实验室制备氯气的反应是二氧化锰和浓盐酸加热反应生成氯化锰、氯气和水;
②依据氯气含有氯化氢和水蒸气分析装置B的作用,氯气是有毒气体不能排放到空气中;
(3)反应中KMnO4→MnCl2,Mn元素化合价由+7降低为+2,共降低5价,HCl(浓)→Cl2,Cl元素化合价由-1价升高为0价,共升高为2价,化合价升降最小公倍数为10,故KMnO4的系数为2,Cl2的系数为5,再根据原子守恒配平其它物质的系数.
解答:
解:(1)装置中a是向烧瓶中加入浓盐酸的仪器为分液漏斗;
故答案为:分液漏斗;
(2)①制备氯气是利用装置加热生成,试剂是二氧化锰和浓盐酸加热反应生成,反应的化学方程式为:MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O;
故答案为:MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O;
②氯气中含有氯化氢气体和水蒸气,氯化氢也可以被高锰酸钾溶液氧化,需要用饱和氯化钠溶液除去,避免干扰二氧化硫的检验,氯气有毒污染空气不能排放到空气中,烧杯中的氢氧化钠溶液吸收氯气防止污染;
故答案为:饱和NaCl溶液;吸收氯气防污染;
(3)反应中KMnO4→MnCl2,Mn元素化合价由+7降低为+2,共降低5价,HCl(浓)→Cl2,Cl元素化合价由-1价升高为0价,共升高为2价,化合价升降最小公倍数为10,故KMnO4的系数为2,Cl2的系数为5,再根据原子守恒配平其它物质的系数,配平后的离子方程式为2MnO4-+16H++10Cl-═2Mn2++5Cl2↑+8H2O,
故答案为:2MnO4-;10;16;2;5;8H2O.
故答案为:分液漏斗;
(2)①制备氯气是利用装置加热生成,试剂是二氧化锰和浓盐酸加热反应生成,反应的化学方程式为:MnO2+4HCl(浓)
| ||
故答案为:MnO2+4HCl(浓)
| ||
②氯气中含有氯化氢气体和水蒸气,氯化氢也可以被高锰酸钾溶液氧化,需要用饱和氯化钠溶液除去,避免干扰二氧化硫的检验,氯气有毒污染空气不能排放到空气中,烧杯中的氢氧化钠溶液吸收氯气防止污染;
故答案为:饱和NaCl溶液;吸收氯气防污染;
(3)反应中KMnO4→MnCl2,Mn元素化合价由+7降低为+2,共降低5价,HCl(浓)→Cl2,Cl元素化合价由-1价升高为0价,共升高为2价,化合价升降最小公倍数为10,故KMnO4的系数为2,Cl2的系数为5,再根据原子守恒配平其它物质的系数,配平后的离子方程式为2MnO4-+16H++10Cl-═2Mn2++5Cl2↑+8H2O,
故答案为:2MnO4-;10;16;2;5;8H2O.
点评:本题考查实验室制备氯气的反应原理和装置分析,掌握基本操作和物质性质是解题关键,题目难度中等,离子方程式的配平时难点.

练习册系列答案
 尖子生新课堂课时作业系列答案
尖子生新课堂课时作业系列答案
相关题目
下列说法正确的是( )
| A、人体缺少维生素A易患夜盲症、干眼症 |
| B、玻璃钢广泛用于制造汽车车身、船体和印刷电路板 |
| C、为使火腿肠颜色更鲜红,可多加一些亚硝酸钠 |
| D、碳酸氢钠可作抗酸药,阿司匹林是重要的抗生素 |
 在如图装置中,烧瓶中充满干燥体a,将滴管中的液体b挤入烧瓶内,轻轻振荡烧瓶,然后打开弹簧夹f,烧杯中的液体b呈喷泉状喷出.则a和b不可能是( )
在如图装置中,烧瓶中充满干燥体a,将滴管中的液体b挤入烧瓶内,轻轻振荡烧瓶,然后打开弹簧夹f,烧杯中的液体b呈喷泉状喷出.则a和b不可能是( )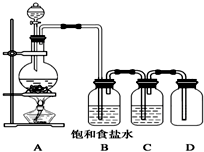 用如图装置制取并收集氯气,试回答下列问题:
用如图装置制取并收集氯气,试回答下列问题: