题目内容
下表标出的是元素周期表的一部分元素,回答下列问题:

(1)表中用字母标出的14种元素中,化学性质最不活泼的是 (用元素符号表示,下同),非金属性最强的是 ,属于过渡元素的是 (该空用字母表示).
(2)除稀有气体外第三周期中原子半径最小的是 (填元素符号),
(3)最高价氧化物对应的水化物酸性最强的是 (填化学式).最高价氧化物对应的水化物碱性最强的是 (填化学式).气态氢化物最稳定的是 (填化学式)
(4)H与过量的稀硫酸反应,为了加快反应速率,但是又不影响生成的氢气总量,可以采取的措施是
①升高温度②加入适量的水③加入少量CuSO4④把稀硫酸换成浓硫酸⑤把H粉碎⑥加入NaNO3溶液⑦加入少量氢氧化钠溶液.

(1)表中用字母标出的14种元素中,化学性质最不活泼的是
(2)除稀有气体外第三周期中原子半径最小的是
(3)最高价氧化物对应的水化物酸性最强的是
(4)H与过量的稀硫酸反应,为了加快反应速率,但是又不影响生成的氢气总量,可以采取的措施是
①升高温度②加入适量的水③加入少量CuSO4④把稀硫酸换成浓硫酸⑤把H粉碎⑥加入NaNO3溶液⑦加入少量氢氧化钠溶液.
考点:元素周期律和元素周期表的综合应用
专题:元素周期律与元素周期表专题
分析:由元素在周期表中位置,可知A为氟、B为氧、C为磷、D为碳、E为Ar、F为Cl、G为硫、H为Al、I为Mg、J为Na、K为Ca、L为钾、N为Br,M属于过渡元素;
(1)稀有气体化学性质最不活泼;同周期自左而右非金属性增强,同主族自上而下非金属性减弱;M处于过渡元素;
(2)同周期自左而右原子半径减小;
(3)最高价氧化物对应的水化物酸性最强的是高氯酸;上述元素中K的金属性最强,故氢氧化钾碱性最强;F元素非金属性最强,其氢化物最稳定;
(4)根据影响化学反应速率的因素:温度、浓度、固体表面积等方面来分析解答.
(1)稀有气体化学性质最不活泼;同周期自左而右非金属性增强,同主族自上而下非金属性减弱;M处于过渡元素;
(2)同周期自左而右原子半径减小;
(3)最高价氧化物对应的水化物酸性最强的是高氯酸;上述元素中K的金属性最强,故氢氧化钾碱性最强;F元素非金属性最强,其氢化物最稳定;
(4)根据影响化学反应速率的因素:温度、浓度、固体表面积等方面来分析解答.
解答:
解:由元素在周期表中位置,可知A为氟、B为氧、C为磷、D为碳、E为Ar、F为Cl、G为硫、H为Al、I为Mg、J为Na、K为Ca、L为钾、N为Br,M属于过渡元素;
(1)稀有气体Ar的化学性质最不活泼;同周期自左而右非金属性增强,同主族自上而下非金属性减弱,故上述元素中F元素非金属性最强;由元素位置可知,M处于过渡元素,
故答案为:Ar;F;M;
(2)同周期自左而右原子半径减小,故除稀有气体外第三周期中原子半径最小的是Cl,
故答案为:Cl;
(3)最高价氧化物对应的水化物酸性最强的是高氯酸,化学式为HClO4;上述元素中K的金属性最强,故KOH碱性最强;F元素非金属性最强,其氢化物HF最稳定,
故答案为:HClO4;KOH;HF;
(4)①温度升高,反应速率加快,故①正确;
②加入适量的水相当于把酸稀释,氢离子浓度减小,反应速率减慢,故②错误;
③加入少量CuSO4,形成了铝、铜、稀硫酸原电池,反应速率加快,由部分Al置换Cu,生成氢气的总量减少,故③错误;
④金属铝和浓硫酸在常温下钝化,故④错误;
⑤增大固体的接触面积,可以加快反应速率,故⑤正确;
⑥加入NaNO3溶液,溶液中有硝酸存在,反应不生成氢气,故⑥错误;
⑦加氢氧化钠溶液,与硫酸反应生成硫酸钠,氢离子浓度降低,反应速率减慢,故⑦错误,
故选:①⑤.
(1)稀有气体Ar的化学性质最不活泼;同周期自左而右非金属性增强,同主族自上而下非金属性减弱,故上述元素中F元素非金属性最强;由元素位置可知,M处于过渡元素,
故答案为:Ar;F;M;
(2)同周期自左而右原子半径减小,故除稀有气体外第三周期中原子半径最小的是Cl,
故答案为:Cl;
(3)最高价氧化物对应的水化物酸性最强的是高氯酸,化学式为HClO4;上述元素中K的金属性最强,故KOH碱性最强;F元素非金属性最强,其氢化物HF最稳定,
故答案为:HClO4;KOH;HF;
(4)①温度升高,反应速率加快,故①正确;
②加入适量的水相当于把酸稀释,氢离子浓度减小,反应速率减慢,故②错误;
③加入少量CuSO4,形成了铝、铜、稀硫酸原电池,反应速率加快,由部分Al置换Cu,生成氢气的总量减少,故③错误;
④金属铝和浓硫酸在常温下钝化,故④错误;
⑤增大固体的接触面积,可以加快反应速率,故⑤正确;
⑥加入NaNO3溶液,溶液中有硝酸存在,反应不生成氢气,故⑥错误;
⑦加氢氧化钠溶液,与硫酸反应生成硫酸钠,氢离子浓度降低,反应速率减慢,故⑦错误,
故选:①⑤.
点评:本题考查元素周期表与元素周期律、化学反应速率影响因素等,难度中等,(4)中注意Al在浓硫酸中发生钝化,与硝酸反应没有氢气生成,形成Al、Cu、硫酸原电池时,反应速率加快,但生成氢气减少.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
下列有关碳酸钠和碳酸氢钠的叙述中正确的是( )
| A、等质量的两种盐分别与足量盐酸反应,碳酸钠产生的气体多 |
| B、等质量的两种盐分别与足量盐酸反应,碳酸钠反应更剧烈 |
| C、盐酸滴加到碳酸钠溶液中与碳酸钠溶液滴加到盐酸中,两者的现象相同 |
| D、盐酸滴加到碳酸氢钠溶液中与碳酸氢钠溶液滴加到盐酸中,两者的现象相同 |
下列说法正确的是( )
| A、人体缺少维生素A易患夜盲症、干眼症 |
| B、玻璃钢广泛用于制造汽车车身、船体和印刷电路板 |
| C、为使火腿肠颜色更鲜红,可多加一些亚硝酸钠 |
| D、碳酸氢钠可作抗酸药,阿司匹林是重要的抗生素 |
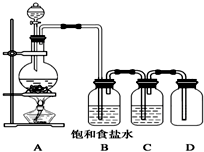 用如图装置制取并收集氯气,试回答下列问题:
用如图装置制取并收集氯气,试回答下列问题: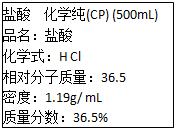 如图是学校实验室从化学试剂商店买回的盐酸试剂标签上的部分内容,据此,完成下列问题:
如图是学校实验室从化学试剂商店买回的盐酸试剂标签上的部分内容,据此,完成下列问题: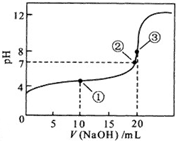 常温下,用0.10mol?L-1NaOH溶液滴定 20.00mL 0.10mol?L-1 CH3COOH溶液滴定曲线如图.
常温下,用0.10mol?L-1NaOH溶液滴定 20.00mL 0.10mol?L-1 CH3COOH溶液滴定曲线如图.