题目内容
下表为长式周期表的一部分,其中的编号代表对应的元素.

(1)表中属丁d区的元素是 (填编号);
(2)③、④两种元素的电负性人小为③ ④(填“>”、“<”、“=”,下同),它们的第一电离能大小为③ ④.
(3)②、⑤、⑧元素的单质熔点高低的顺序是 (用编号表示).
(4)③元素的氢化物住水中的溶解度比同族元素的其它氢化物大得多的原因是
(5)⑥与⑧形成的分子最外层都满足8电子稳定结构,则在分子中⑥原子的杂化轨道的形式是 .分子空间构型是 .
(6)1183K以下,⑨元素形成品体的基本结构单元如图1所示1183K以上基本结构单元转变为如图2所示,在两种晶体中最邻近的原子间距离相等.
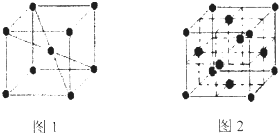
在图2中,与一个⑨原子等距离且最近的⑨原子的个数是 ;图1与图2中含有的⑨原子个数之比为 .

(1)表中属丁d区的元素是
(2)③、④两种元素的电负性人小为③
(3)②、⑤、⑧元素的单质熔点高低的顺序是
(4)③元素的氢化物住水中的溶解度比同族元素的其它氢化物大得多的原因是
(5)⑥与⑧形成的分子最外层都满足8电子稳定结构,则在分子中⑥原子的杂化轨道的形式是
(6)1183K以下,⑨元素形成品体的基本结构单元如图1所示1183K以上基本结构单元转变为如图2所示,在两种晶体中最邻近的原子间距离相等.

在图2中,与一个⑨原子等距离且最近的⑨原子的个数是
考点:元素周期律和元素周期表的综合应用
专题:元素周期律与元素周期表专题
分析:由元素在周期表中位置,可知①为Be、②为C、③为N、④为O、⑤为Mg、⑥为Si、⑦为S、⑧为Cl、⑨为Fe、⑩为Cu.
(1)d区元素包含3~10列元素(镧系元素、锕系元素除外);
(2)同周期随原子序数增大电负性增大,N元素2p能级容纳3个电子,为半满稳定状态,能量较低,第一电离能高于同周期相邻元素;
(3)根据晶体类型及物质的状态判断;
(4)氨气能与水反应,且能与水分子之间形成氢键;
(5)⑥与⑧形成的分子最外层都满足8电子稳定结构,该分子为SiCl4,根据Si原子所成σ键数目确定其杂化方式,进而确定空间结构;
(6)图2中,以定点原子为研究对象,与之最近的原子处于面心上,每个顶点为12面共用;根据均摊法计算晶胞中原子数目,进而计算两种晶胞中含有原子数目之比.
(1)d区元素包含3~10列元素(镧系元素、锕系元素除外);
(2)同周期随原子序数增大电负性增大,N元素2p能级容纳3个电子,为半满稳定状态,能量较低,第一电离能高于同周期相邻元素;
(3)根据晶体类型及物质的状态判断;
(4)氨气能与水反应,且能与水分子之间形成氢键;
(5)⑥与⑧形成的分子最外层都满足8电子稳定结构,该分子为SiCl4,根据Si原子所成σ键数目确定其杂化方式,进而确定空间结构;
(6)图2中,以定点原子为研究对象,与之最近的原子处于面心上,每个顶点为12面共用;根据均摊法计算晶胞中原子数目,进而计算两种晶胞中含有原子数目之比.
解答:
解:由元素在周期表中位置,可知①为Be、②为C、③为N、④为O、⑤为Mg、⑥为Si、⑦为S、⑧为Cl、⑨为Fe、⑩为Cu.
(1)d区元素包含3~10列元素(镧系元素、锕系元素除外),故⑨号元素处于d区,故答案为:⑨;
(2)同周期随原子序数增大电负性增大,故电负性N<O;N元素2p能级容纳3个电子,为半满稳定状态,能量较低,第一电离能高于同周期相邻元素,故第一电离能N>O,故答案为:<;>;
(3)②的单质金刚石为原子晶体,故碳单质熔点最高,常温下Mg为固体,氯气为气体,故Mg的熔点高于氯气,故单质熔点高低的顺序是:②>⑤>⑧,故答案为:②>⑤>⑧;
(4)氨气能与水反应,且能与水分子之间形成氢键,故氨气在水的溶解度比同主族其它氢化物大的多,
故答案为:氨气分子与分子形成氢键且发生化学反应;
(5)⑥与⑧形成的分子最外层都满足8电子稳定结构,该分子为SiCl4,分子中Si原子成4个σ键,没有孤电子对,杂化轨道数目为4,采取sp3杂化方式,杂化轨道全部参与成键,故其空间结构为正四面体,
故答案为:sp3;正四面体;
(6)图2中,以定点原子为研究对象,与之最近的原子处于面心上,每个顶点为12面共用,故与一个⑨原子等距离且最近的⑨原子的个数是12;
图1晶胞中原子数目=1+8×
=2,图2晶胞中原子数目=6×
+8×
=4,故图1与图2中含有的⑨原子个数之比为2:4=1:2,
故答案为:12;1:2.
(1)d区元素包含3~10列元素(镧系元素、锕系元素除外),故⑨号元素处于d区,故答案为:⑨;
(2)同周期随原子序数增大电负性增大,故电负性N<O;N元素2p能级容纳3个电子,为半满稳定状态,能量较低,第一电离能高于同周期相邻元素,故第一电离能N>O,故答案为:<;>;
(3)②的单质金刚石为原子晶体,故碳单质熔点最高,常温下Mg为固体,氯气为气体,故Mg的熔点高于氯气,故单质熔点高低的顺序是:②>⑤>⑧,故答案为:②>⑤>⑧;
(4)氨气能与水反应,且能与水分子之间形成氢键,故氨气在水的溶解度比同主族其它氢化物大的多,
故答案为:氨气分子与分子形成氢键且发生化学反应;
(5)⑥与⑧形成的分子最外层都满足8电子稳定结构,该分子为SiCl4,分子中Si原子成4个σ键,没有孤电子对,杂化轨道数目为4,采取sp3杂化方式,杂化轨道全部参与成键,故其空间结构为正四面体,
故答案为:sp3;正四面体;
(6)图2中,以定点原子为研究对象,与之最近的原子处于面心上,每个顶点为12面共用,故与一个⑨原子等距离且最近的⑨原子的个数是12;
图1晶胞中原子数目=1+8×
| 1 |
| 8 |
| 1 |
| 2 |
| 1 |
| 8 |
故答案为:12;1:2.
点评:本题是对物质结构的考查,涉及元素周期表、电负性、电离能、晶体类型与性质、杂化轨道、分子结构与性质、晶胞计算等,比较全面考查物质结构主干知识,需要学生具备扎实的基础,难度中等.

练习册系列答案
相关题目
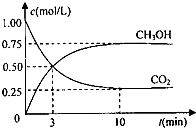 为实现“节能减排”和“低碳经济”的一项课题是如何将CO2转化为可利用资源.
为实现“节能减排”和“低碳经济”的一项课题是如何将CO2转化为可利用资源.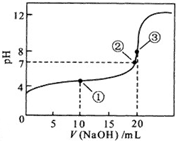 常温下,用0.10mol?L-1NaOH溶液滴定 20.00mL 0.10mol?L-1 CH3COOH溶液滴定曲线如图.
常温下,用0.10mol?L-1NaOH溶液滴定 20.00mL 0.10mol?L-1 CH3COOH溶液滴定曲线如图.